速度論は、化学反応の速度を研究する物理化学の分野です。 対照的に、熱力学は、反応速度を明らかにすることなく、反応のどちらの方向が好ましいかを示します。 一部の反応は、熱力学的には有利ですが、速度論的には不利になる可能性があります。
たとえば、ダイヤモンドからグラファイトへの変換では、グラファイトはダイヤモンドよりも自由エネルギーが低いため、熱力学的に変換が優先されます。 しかし、ダイヤモンドがすべての結合を破壊し、より多くのものに再形成するための大きな活性化障壁があります 安定したグラファイト構成であるため、この反応は速度論的に不利であり、実際には発生しません。
反応速度
ザ・ 反応速度 は、生成物が形成され、反応物が消費される速度の尺度であるため、一定期間にわたる生成物または反応物の濃度の変化を測定することによってそれを決定できます。 一般的な化学反応を考えてみましょう。
aA + bB> cC + dD
反応速度は次のように書くことができます。
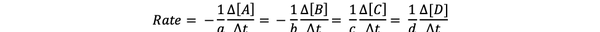
•••から変更 https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
たとえば、次の反応速度:
2 NO(g)+ 2 H2 (g)> N2(g)+ 2 H2O(g)
によって与えられます
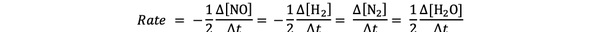
•••から適応 https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
実験によってこの反応の速度を決定するために、Hの濃度を測定することができます2 反応のさまざまな時間で、次のように時間に対してプロットします。
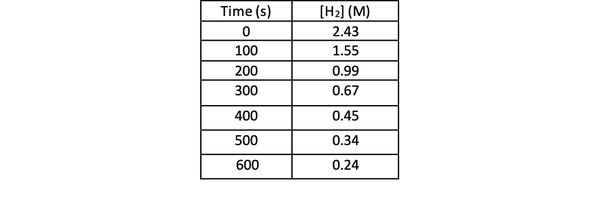
•••から変更 https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
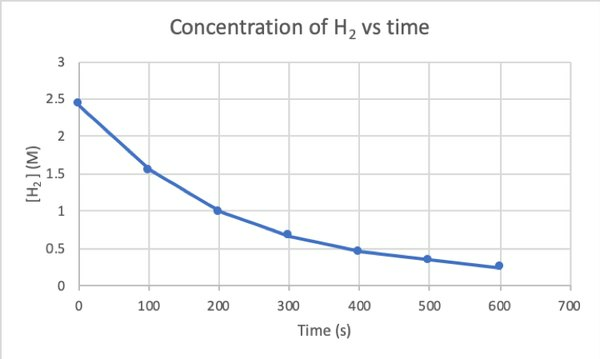
•••から変更 https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
ザ・ 平均反応速度 は時間間隔での反応速度の概算であり、次のように表すことができます。
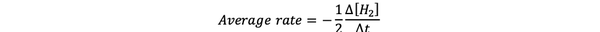
•••から変更 https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
ザ・ 瞬間反応速度 ある瞬間の反応速度として定義されます。 これは差分レートであり、次のように表すことができます。
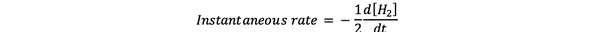
•••から変更 https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
ここでd [H2] / dtは、Hの濃度曲線の傾きです。2 対時間tでの時間。
ザ・ 初期反応速度 t = 0の場合、反応開始時の瞬間速度です。 この場合、 単位 平均の場合、瞬間的および初期反応速度はM / sです。
レート法
ほとんどの場合、反応速度は時間tでのさまざまな反応物の濃度に依存します。 たとえば、すべての反応物の濃度が高い場合、反応物はより頻繁に衝突し、より速い反応をもたらします。 反応速度ν(t)と濃度の関係は次のように定義されます。 レート法. また、一般的な化学反応aA + bB> cC + dDの反応速度式は次のとおりです。
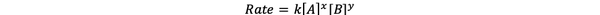
•••から変更 https://chem.libretexts.org/Bookshelves/Ancillary_Materials/Laboratory_Experiments/Wet_Lab_Experiments/General_Chemistry_Labs/Online_Chemistry_Lab_Manual/Chem_12_Experiments/01%3A_Chemical_Kinetics_-_The_Method_of_Initial_Rates_(Experiment)
ここで、kは速度定数、累乗xおよびyは 注文 反応物AおよびBに関する反応の。 反応速度式は実験的に決定する必要があり、バランスの取れた化学反応の化学量論だけから推測することはできません。
初期料金の方法
速度則は、 初期料金の方法. この方法では、実験は複数回実行され、他の変数を一定に保ちながら、実行ごとに1つの反応物の濃度を変更するだけです。 反応速度は、反応速度式の各反応物の順序を決定するために、実行ごとに測定されます。
たとえば、反応の次の初期速度データについて考えてみます。
2 NO(g)+ 2 H2 (g)> N2(g)+ 2 H2O(g)
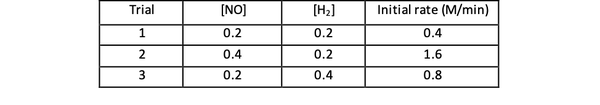
•••から適応 https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
試験1および3では、NOの濃度は一定に保たれ、Hの濃度は一定に保たれます。2 倍増します。 その結果、初期反応速度も2倍になりました(2と考えてください)。1)、したがって、y = 1と結論付けることができます。 試験1および2では、NOの濃度は2倍になり、Hの濃度は2倍になります。2 一定のまま。 この変更の結果、初期レートは4倍になります(2と考えてください)。2). したがって、x = 2と結論付けることができます。
したがって、この反応の反応速度式は次のとおりです。
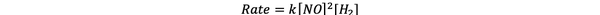
•••から適応 https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
そして反応は 最初の注文 Hで2 そして 二次 いいえ。
