Uma fórmula química é uma notação padrão simplificada para explicar uma reação química usada em experimentos. Eles podem parecer complicados, mas quando você aprende a lê-los, eles se tornam bastante autoexplicativos.
Veja a reação química que você está tentando decompor como uma equação. Procure palavras-chave, especificamente os componentes químicos envolvidos. Por exemplo, o metano (CH4) é queimado, o que sempre significa que é feito em oxigênio (O2). Isso produz vapor de dióxido de carbono (CO2) e água (H2O). Observe a localização da palavra "Rendimentos", pois isso é importante.
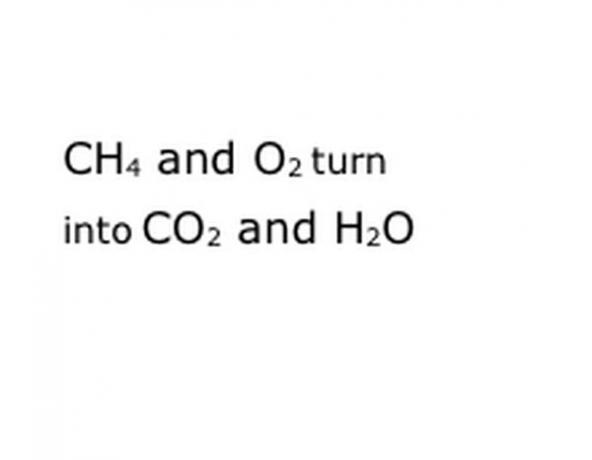
Escreva os componentes químicos da reação no formato de notação padrão. Em nosso exemplo, isso será CH4, O2, CO2 e H2O. Em química, "render" significa que tudo o que vem antes se transforma em tudo que vem depois, portanto, certifique-se de que "produzir" esteja mais ou menos no meio. Essa frase representará a reação química real, neste caso a queima. Portanto, qualquer coisa que você vai queimar deve estar antes disso, e qualquer coisa que a reação produzir deve vir depois.
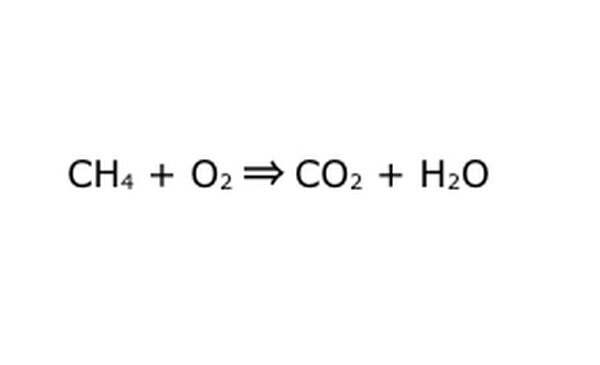
Reescreva a equação como um processo matemático. Substitua "rendimento" ou "transforma-se em" por uma seta e desenhe sinais de mais entre os componentes químicos. Para simplificar as coisas, pense em cada componente químico como uma molécula individual. Pode ajudar desenhar as moléculas em um pedaço de papel. Certifique-se de que todas as moléculas que entram estão representadas saindo. Se houver algo faltando no produto final, você pode adicionar de uma forma que faça sentido - compare tudo com o que você sabe sobre ligação covalente. Como a maioria dos experimentos é feita na atmosfera normal, você pode adicionar O2, se necessário, às reações de queima. Se a equação for reversível, certifique-se de que haja uma seta dupla para representá-la.
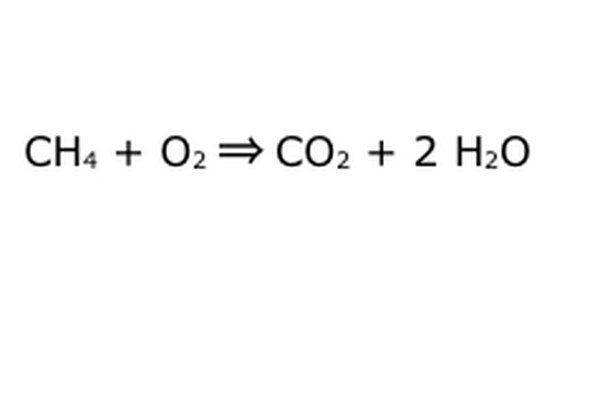
Equilibre sua equação. É aqui que a Lei da Conservação entra em jogo: pense na flecha, nossa reação, como uma máquina na qual você despejou todos os componentes à esquerda. A máquina não fará ou adicionará nada que você não colocou e, portanto, apenas cuspirá a mesma quantidade de material que você colocou. Neste exato momento, temos duas moléculas de hidrogênio em excesso flutuando, porque você colocou "4" em. O único lugar que ele pode ir nesta máquina é em um dos produtos, então ele terá que ir para as moléculas de água. Escreva um "2" na frente do H2O para indicar que para cada CH4 inserido, você receberá dois H2O de volta.

Observe que ainda há um pequeno problema com nossa equação: não há oxigênio suficiente entrando. Há quatro átomos de oxigênio saindo, mas apenas dois entrando, então a coisa toda ainda está desequilibrada. Escreva um "2" na frente do O2 para representar que você tem que colocar dois O2 para obter o suficiente da reação.
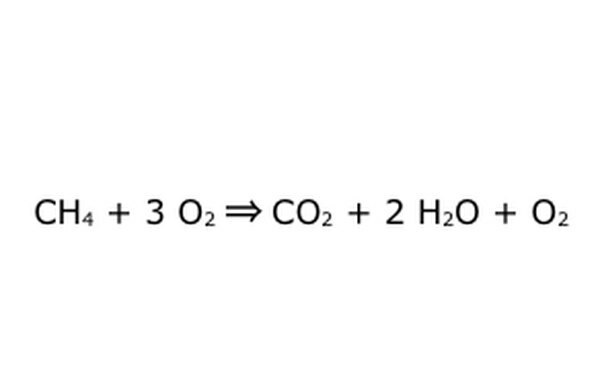
Observe que é possível fazer um processo como este "com excesso de oxigênio". Isso significa que a equação coloca mais oxigênio do que o necessário e recebe mais de volta. Para o exemplo, observe que há um O2 extra entrando, então há um extra saindo. Apenas certifique-se de que a Lei da Conservação seja observada em todos os momentos. Tudo o que entra tem que sair.
Pontas
Geralmente, os produtos químicos nesses tipos de equações são medidos em moles. Uma mole é uma unidade que representa 6,0221415 10 ^ (23) moléculas. Como esse é um número grande demais para ser compreendido, é mais fácil pensar em termos de moléculas únicas durante o equilíbrio. Esteja ciente disso ao iniciar.
