Een chemische formule is een vereenvoudigde, standaardnotatie voor het verklaren van een chemische reactie die in experimenten wordt gebruikt. Ze zien er misschien ingewikkeld uit, maar als je ze leert lezen, worden ze redelijk duidelijk.
Kijk naar de chemische reactie die je probeert op te splitsen als een vergelijking. Zoek naar sleutelwoorden, met name de betrokken chemische componenten. Methaan (CH4) wordt bijvoorbeeld verbrand, wat altijd betekent dat het in zuurstof (O2) gebeurt. Hierbij ontstaat zowel kooldioxide (CO2) als waterdamp (H2O). Let op de locatie van het woord 'Opbrengsten', want dit is belangrijk.
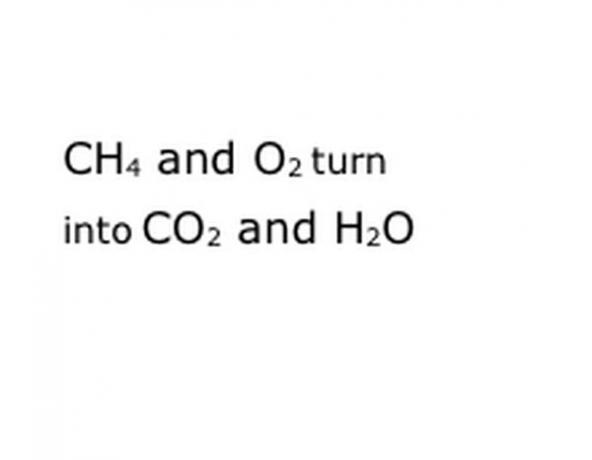
Schrijf de chemische componenten van de reactie in het standaardnotatieformaat. In ons voorbeeld is dit CH4, O2, CO2 en H2O. In de scheikunde betekent "opbrengst" dat alles wat ervoor is, verandert in wat erna komt, dus zorg ervoor dat "opbrengst" ongeveer in het midden ligt. Die zin vertegenwoordigt de eigenlijke chemische reactie, in dit geval de verbranding. Dus alles wat je verbrandt, moet ervoor zijn, en alles wat de reactie oplevert, moet erna zijn.
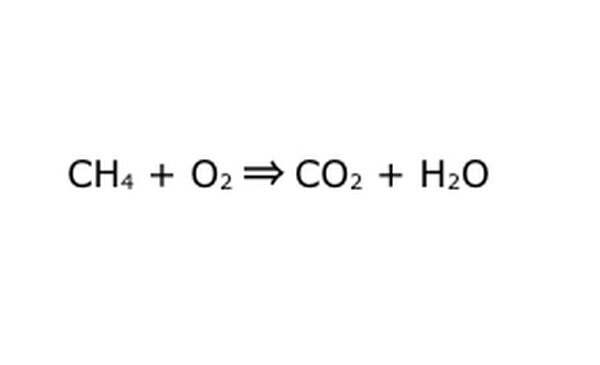
Herschrijf de vergelijking als een wiskundig proces. Vervang "opbrengst" of "draait in" door een pijl en teken plustekens tussen de chemische componenten. Om dingen te vereenvoudigen, beschouw elke chemische component als een individueel molecuul. Het kan helpen om de moleculen op een stuk kladpapier te tekenen. Zorg ervoor dat alle moleculen die erin gaan, worden weergegeven als ze eruit komen. Als er iets ontbreekt aan het eindproduct, kun je dat op een logische manier toevoegen: vergelijk alles met wat je weet over covalente binding. Omdat de meeste experimenten in de reguliere atmosfeer worden gedaan, kun je indien nodig O2 toevoegen aan verbrandingsreacties. Als de vergelijking omkeerbaar is, zorg er dan voor dat deze een dubbele pijl heeft om dat weer te geven.
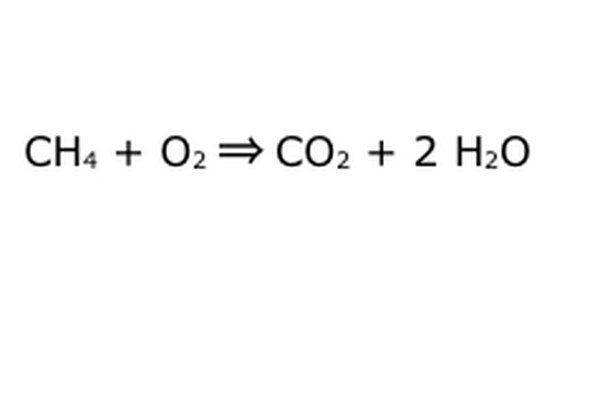
Breng je vergelijking in evenwicht. Dit is waar de wet van behoud in het spel komt: denk aan de pijl, onze reactie, als een machine waarin je alle componenten aan de linkerkant hebt gedumpt. De machine zal niets maken of toevoegen wat je er niet in hebt gedaan, en daarom zal het alleen dezelfde hoeveelheid dingen uitspugen als je erin stopt. Op dit precieze moment zweven er twee overtollige waterstofmoleculen rond, omdat je "4" erin stopt. De enige plaats in deze machine is in een van de producten, dus het zal in de watermoleculen moeten gaan. Schrijf een "2" voor de H2O om aan te geven dat je voor elke CH4 die je erin stopt twee H2O terugkrijgt.

Merk op dat er nog een klein probleem is met onze vergelijking: er gaat niet genoeg zuurstof naar binnen. Er komen vier zuurstofatomen uit, maar er gaan er maar twee in, en dus is het geheel nog steeds uit balans. Schrijf een "2" voor de O2 om aan te geven dat je er twee O2 in moet doen om genoeg uit de reactie te halen.
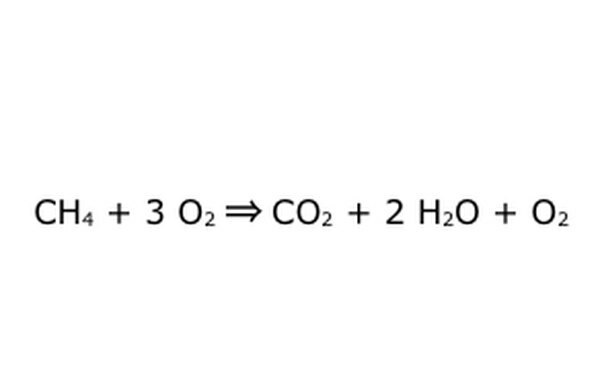
Merk op dat het mogelijk is om een proces als dit uit te voeren "met een teveel aan zuurstof". Dit betekent dat de vergelijking meer zuurstof inbrengt dan nodig is en meer terugkrijgt. Houd er bijvoorbeeld rekening mee dat er een extra O2 naar binnen gaat, dus er komt een extra uit. Zorg er wel voor dat de Wet van Behoud te allen tijde wordt nageleefd. Alles wat erin gaat, moet eruit.
Tips
Over het algemeen worden chemicaliën in dit soort vergelijkingen gemeten in mol. Een mol is een eenheid die staat voor 6.0221415 10^(23) moleculen. Omdat dit een veel te groot aantal is om te begrijpen, is het gemakkelijker om bij het balanceren in termen van afzonderlijke moleculen te denken. Houd hier rekening mee bij het starten.
