化学式は、実験で使用される化学反応を説明するための簡略化された標準表記です。 それらは複雑に見えるかもしれませんが、あなたがそれらを読む方法を学ぶとき、それらはかなり自明になります。
あなたが分解しようとしている化学反応を方程式として見てください。 キーワード、特に関連する化学成分を探します。 たとえば、メタン(CH4)は燃焼されます。これは、常に酸素(O2)で行われることを意味します。 これにより、二酸化炭素(CO2)と水蒸気(H2O)の両方が生成されます。 これは重要なので、「Yields」という単語の場所に注意してください。
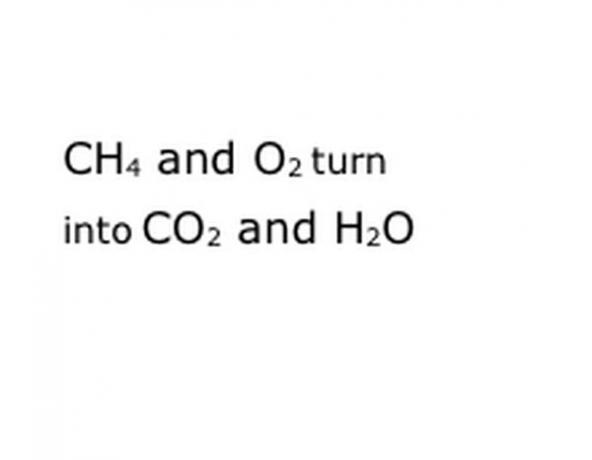
反応の化学成分を標準の表記形式で記述します。 この例では、これはCH4、O2、CO2、およびH2Oになります。 化学では、「収量」とは、前にあるものが後に続くものに変わることを意味するので、「収量」がほぼ中間にあることを確認してください。 そのフレーズは実際の化学反応、この場合は燃焼を表します。 したがって、燃焼するものはすべてその前になければならず、反応がもたらすものはすべて後になければなりません。
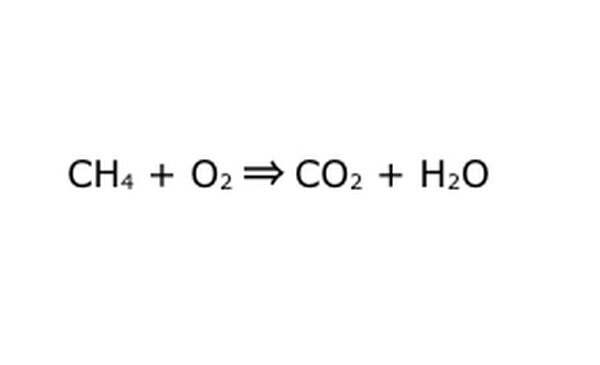
方程式を数学的プロセスとして書き直します。 「yield」または「turnesinto」を矢印に置き換え、化学成分の間にプラス記号を描きます。 物事を単純化するために、各化学成分を個々の分子と考えてください。 スクラップ紙に分子を引き出すのに役立つ場合があります。 入ってくるすべての分子が出てくるように表現されていることを確認してください。 最終製品に不足しているものがある場合は、意味のある方法でそれを追加できます。共有結合について知っていることと照らし合わせて確認してください。 ほとんどの実験は通常の雰囲気で行われるため、必要に応じて燃焼反応にO2を加えることができます。 方程式が可逆的である場合は、それを表す二重矢印があることを確認してください。
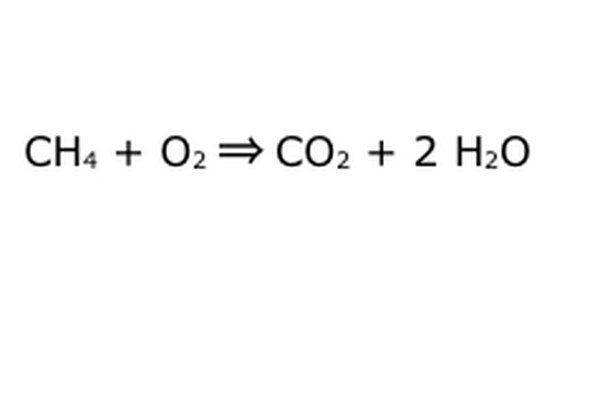
方程式のバランスを取ります。 ここで保存則が作用します。矢印、つまり私たちの反応を、左側のすべてのコンポーネントをダンプしたマシンと考えてください。 マシンはあなたが入れなかったものを作ったり追加したりしないので、あなたが入れたのと同じ量の物を吐き出すだけです。 この正確な瞬間に、「4」を入力したため、2つの過剰な水素分子が浮かんでいます。 この機械でそれが入ることができる唯一の場所は製品の1つにあるので、それは水分子に入る必要があります。 H2Oの前に「2」と書いて、入力したCH4ごとに2つのH2Oが返されることを示します。

私たちの方程式にはまだ小さな問題があることに注意してください。十分な酸素が入っていないのです。 出てくる酸素原子は4つありますが、入ってくるのは2つだけなので、全体がまだ不均衡です。 O2の前に「2」を書いて、反応から十分に抜け出すために2つのO2を入れなければならないことを表します。
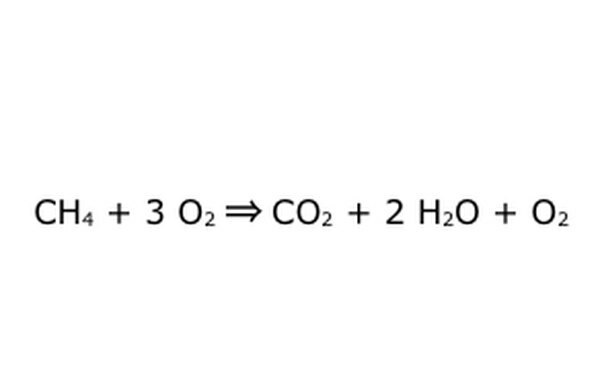
このようなプロセスを「過剰な酸素で」行うことが可能であることに注意してください。 これが意味するのは、方程式が必要以上の酸素を投入し、より多くを取り戻すということです。 この例では、余分なO2が入ってくるので、余分に出てくることに注意してください。 保存則が常に遵守されていることを確認してください。 入ってくるものはすべて出なければなりません。
チップ
一般に、これらのタイプの方程式の化学物質はモルで測定されます。 モルは、6.0221415 10 ^(23)分子を表す単位です。 これは数が大きすぎて理解できないため、バランスをとるときに単一分子の観点から考える方が簡単です。 開始するときはこれに注意してください。
