炭素は、Cの化学記号を持つ非金属元素です。 これは、宇宙で4番目に豊富な元素であり、地球の地殻で15番目に豊富な元素です。 また、酸素に次いで人間に2番目に豊富な元素です。 その化学的構成は、炭素のいくつかのユニークな特性につながります。
炭素は周期表のグループ14に属しています。 原子番号は6で、原子量は12.011です。 炭素の酸化状態は-4から+4まで変化します。ここで、+ 4はメタンや二硫化炭素などの化合物に存在し、+ 2は一酸化炭素に存在します。
さまざまな炭素同素体の物理的特性により、電池、電子機器、ナノ材料に役立ちます。 炭素は「元素の王様」でもあり、ほとんどを形成します 1000万の化合物 これまで、有機、無機、有機金属化合物を含みます。
炭素の同位体は、放射性炭素年代測定(炭素14)、分子構造、医学研究(炭素13)に広く使用されています。 さらに、炭素繊維は優れた機械的特性を示し、航空宇宙および土木工学で人気があります。
炭素の同素体
カーボンは違う 同素体、多様な分子構成と原子構造を持つ。 炭素の物理的性質は、各同素体によって大きく異なります。 炭素の最もよく知られている同素体には、グラファイト、ダイヤモンド、フラーレンなどがあります。
グラファイトは、最も柔らかい既知の材料の1つであり、鉛筆や固体潤滑剤として使用されます。 また、優れた電気伝導体であり、バッテリーやソーラーパネルに役立ちます。
グラフェンは、ハニカム格子に配置されたグラファイトの1つの原子層です。 グラフェン層では、各炭素原子が他の3つの原子に共有結合し、4番目の電子が平面内を自由に移動できるようになります。
それどころか、ダイヤモンドは最も硬い天然物質であり、炭素のユニークな特性の1つです。 グラファイトのほぼ2倍の密度を持ち、各炭素原子は他の4つの炭素原子と四面体結合しており、自由に流れる電子はありません。 したがって、ダイヤモンドは電気の伝導性が低いです。 ダイヤモンドは、不透明なグラファイトとは異なり、外観も透明です。
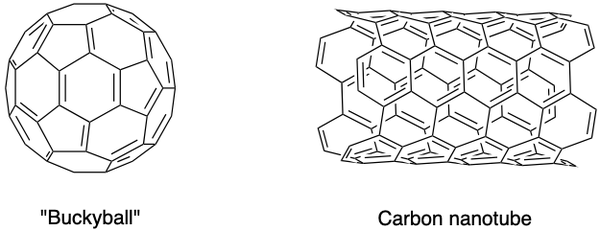
科学者たちはまた、フラーレン、カーボンナノフォームなどの他の炭素同素体を合成しました。 それらは特別な特性を持っており、 ナノマテリアル. フラーレンは、閉じたケージ(バッキーボール)またはシリンダー(カーボンナノチューブ)コンフォメーションの中空炭素分子のグループです。
•••ChemDrawを使用して作成
C60 バッキーボールは、ハロルド・クロトー卿、リチャード・スモーリー、ロバート・カール・ジュニアによって、ヘリウム雰囲気でグラファイトロッドを気化させるためにレーザーを使用して発見されました。 炭素原子は単結合と二重結合で結合され、サッカーボールの形をした12個の五角形と20個の六角形の面を形成します。 彼らの先駆的な努力により、1996年にノーベル賞を受賞しました。
バッキーボールの細長いバージョンであるカーボンナノチューブは、飯島澄男によって識別されました。 それらは熱と電気の優れた伝導体であり、電子機器に役立ちます。
カーボンナノチューブはまた、印象的な引張強度を示し、構造材料や医療において刺激的な用途を持っています。 しかし、そのようなナノ材料の制御された合成は、科学者に大きな課題をもたらしました。
炭素の化学反応性
炭素は地球上の生命の基盤を形成しており、何百万もの炭素含有化合物がすべての生物の18パーセントを占めています。 それは他の原子と安定した共有結合を形成し、強力な相互接続炭素-炭素結合の長い鎖または環として現れる可能性があります。 これらは、地球上に存在する炭素化合物の多様性と複雑さに貢献しています。
これら 炭素化合物 生体の細胞に見られるタンパク質、炭水化物、DNAなどの有機分子や、炭素酸化物などの無機化合物が含まれます。 有機分子の研究は、有機化学と呼ばれる専門分野を構成しています。 炭素は、有機金属化合物として金属と共有結合を形成することもできます。 ヘモグロビンの酸素結合部位である鉄ポルフィリンはそのような例です。
自然界に豊富に存在するにもかかわらず、炭素は通常の条件下では比較的反応しません。 標準温度では、酸(硫酸または塩酸)またはアルカリに対して反応しません。 また、この温度での酸化に対しても安定しています。 ただし、高温では、炭素が酸素と反応して一酸化炭素(CO)を形成する可能性があります。2 およびCO)、硫黄ガスを用いて二硫化炭素を形成し、シリコンを用いて炭化物を形成する。
炭素の同位体
炭素には15の既知の同位体があり、そのうち炭素12(天然炭素の98.93パーセント)と炭素13(1.07パーセント)が2つの安定同位体です。 炭素14は最も寿命の長い同位体であり、半減期は5、730年です。 最短寿命の炭素同位体は炭素8であり、半減期は1.98739 x10です。−21 秒。
同位体炭素14は次のように表されます。 146C、ここで、上付き文字14は原子量、下付き記号6は原子番号です。 炭素14は天然存在比が非常に低い(0.0000000001パーセント)が、半減期が長いため、 放射年代測定.
炭素14は、窒素14が宇宙線からの中性子と反応して、この過程で陽子を放出するときに形成されます。 次に、炭素14は酸素と反応して生成します 14CO2、大気中に均一に分布している 12CO2.
147N + 10n> 146C + 11p
炭素循環は、生物が二酸化炭素を変換するときに始まります(14CO2 そして 12CO2 大気から)光合成によって有機化合物に変換され、呼吸によって大気中に放出されます。 この平衡状態では、次の固定比率があります。 14CO2 そして 12CO2 生物の中で。 しかし、それらが死ぬと、平衡は停止し、炭素14は5、730年の半減期に従って窒素14へのベータ崩壊を起こします。
146C> 147N + 0-1e
したがって、死んだ標本中の炭素14の相対的な割合を測定することで、その死後の経過時間を計算することができます。 この放射性炭素年代測定法は、500年から50、000年前の化石や考古学的標本の年代測定に広く使用されています。
炭素13は、多くのアプリケーションで広く使用されているもう1つの同位体です。 たとえば、有機化合物の分子構造を決定するための核磁気共鳴(NMR)で使用されます。 また、医学研究用の質量分析計と組み合わせたラベリングツールとしても使用されます。
炭素繊維の機械的性質
炭素はまた、その物理的、化学的および核的特性以外に、有用な機械的特性を示します。
それは形成することができます 合金 鋼から炭素鋼への変換。炭素含有量は0.05から2重量パーセントまで変化します。 中炭素鋼(0.3-0.6%炭素)は、バランスの取れた強度と延性、および優れた引張強度を備えています。 熱処理のプロセスを通じて、超高炭素鋼(1.25〜2パーセントの炭素)を非常に高い硬度に焼き戻し、ナイフの製造に使用することができます。
炭素繊維は、主に炭素原子で構成された5〜10μmの太さの繊維であり、高い 剛性、引張強度、耐薬品性、耐熱性、軽量および熱 拡張。 鋼の降伏強度はそのグレードに依存し、軟鋼の降伏強度は247MPaです。 炭素繊維は 引張強度は1,600〜6,370 MPaの範囲であるため、航空宇宙、土木工学、および スポーツ。
材料に応力がかかると、最初は弾性変形します。 この段階で、応力を取り除くと元の形状に戻ることができます。 降伏強さ 材料が永久変形することなく耐えることができる応力として定義されます。
元の寸法に戻れなくなるポイント(上部降伏ポイント)に達すると、塑性変形が発生します。これは永続的で不可逆的です。 引張強度は、材料が破損または破損することなく耐えることができる最大強度です。
