נוסחה כימית היא סימון סטנדרטי פשוט להסבר תגובה כימית המשמשת בניסויים. הם אולי נראים מסובכים, אך כשאתה לומד כיצד לקרוא אותם, הם הופכים למבינים את עצמם למדי.
התבונן בתגובה הכימית שאתה מנסה לפרק כמשוואה. חפש מילות מפתח, במיוחד המרכיבים הכימיים המעורבים. לדוגמה, מתאן (CH4) נשרף, מה שמשמעותו תמיד שהוא נעשה בחמצן (O2). זה מניב גם אדי פחמן דו חמצני (CO2) וגם מים (H2O). שימו לב למיקום המילה "תשואות", מכיוון שזה חשוב.
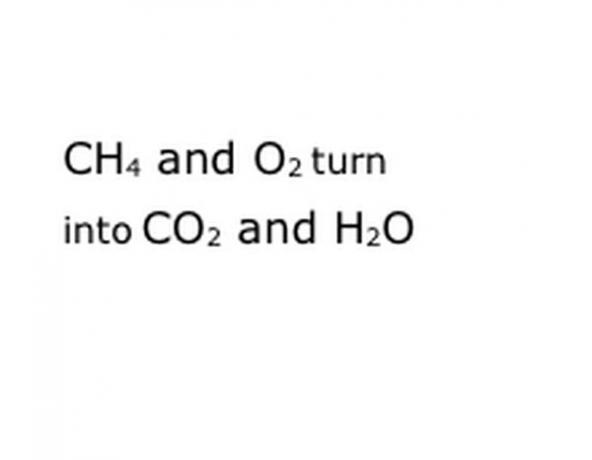
כתוב את המרכיבים הכימיים של התגובה בפורמט הסימון הסטנדרטי. בדוגמה שלנו, זה יהיה CH4, O2, CO2 ו- H2O. בכימיה, "תשואה" פירושו שכל מה שקודם הופך לכל מה שבא אחריו, אז ודא ש"תנובה "בערך באמצע. ביטוי זה ייצג את התגובה הכימית בפועל, במקרה זה השריפה. אז כל מה שתשרפו חייב להיות לפניו, וכל מה שהתגובה מניבה חייב להיות אחריו.
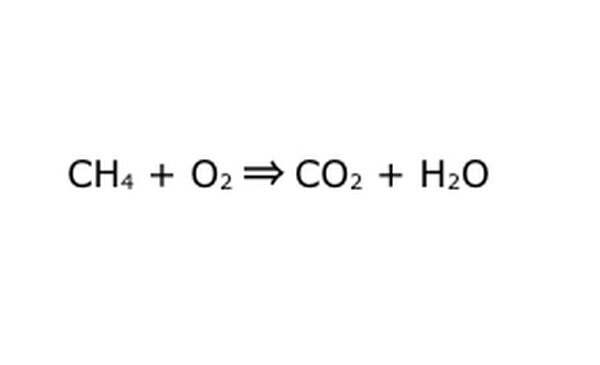
כתוב את המשוואה כתהליך מתמטי. החלף את "תשואה" או "הופך ל" בחץ, ושרטט סימני פלוס בין המרכיבים הכימיים. כדי לפשט את הדברים, חשוב על כל רכיב כימי כעל מולקולה בודדת. זה עשוי לעזור להוציא את המולקולות על פיסת נייר גרוטאות. ודא שכל המולקולות שנכנסות מיוצגות יוצאות החוצה. אם משהו חסר במוצר הסופי, אתה יכול להוסיף את זה בצורה הגיונית - לבדוק כל דבר כנגד מה שאתה יודע על מליטה קוולנטית. מכיוון שרוב הניסויים נעשים באווירה הרגילה, ניתן להוסיף O2 במידת הצורך לתגובות צריבה. אם המשוואה הפיכה, ודא שיש לה חץ כפול לייצג זאת.
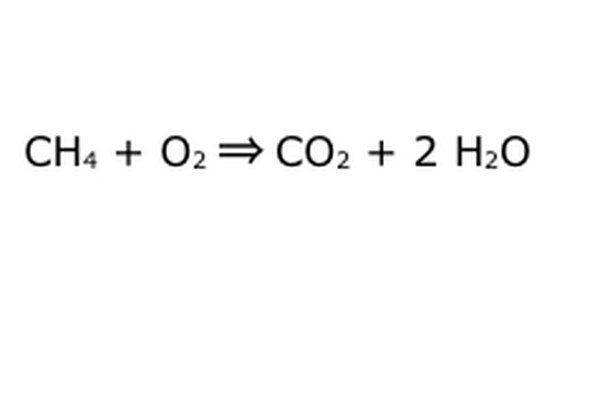
מאזנים את המשוואה שלכם. כאן נכנס לתמונה חוק השימור: חשוב על החץ, התגובה שלנו, כמכונה שאליה זרקת את כל הרכיבים בצד שמאל. המכונה לא תייצר או תוסיף שום דבר שלא הכנסת, ולכן היא רק תיריק את אותה כמות דברים שהכנסת. ברגע המדויק הזה יש לנו שתי מולקולות מימן עודפות שצפות סביב, מכיוון שאתה מכניס "4". המקום היחיד שאליו הוא יכול לעבור במכונה הזו הוא בתוך אחד המוצרים, כך שהוא יצטרך להיכנס למולקולות המים. כתוב "2" מול ה- H2O כדי לציין כי על כל CH4 שתכניס תקבל שני H2O בחזרה.

שים לב שעדיין יש בעיה קטנה במשוואה שלנו: אין מספיק חמצן. ישנם ארבעה אטומי חמצן שיוצאים החוצה, אך רק שניים נכנסים, וכך העניין עדיין לא מאוזן. כתוב "2" מול ה- O2 כדי לייצג שאתה צריך להכניס שני O2 כדי להפיק מספיק מהתגובה.
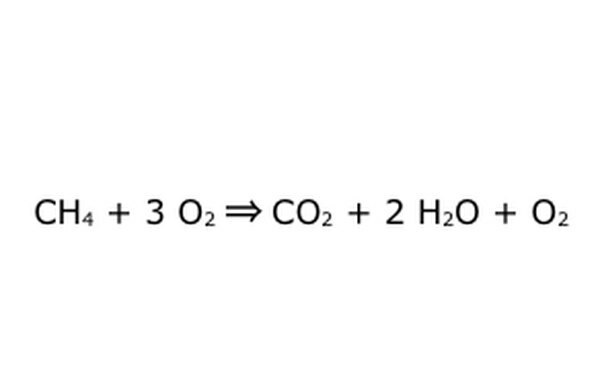
שים לב שאפשר לעשות תהליך כזה "בעודף חמצן". המשמעות של המשמעות היא שהמשוואה מכניסה יותר חמצן מהנדרש ומקבלת יותר בחזרה. לדוגמא, שים לב שיש כניסה נוספת של O2, כך שיש תוספת יוצאת. רק להיות בטוח שחוק השימור נשמר בכל עת. כל מה שנכנס צריך לצאת.
טיפים
בדרך כלל, כימיקלים בסוגים אלו של משוואות נמדדים בשומות. שומה היא יחידה המייצגת 6.0221415 10 ^ (23) מולקולות. מכיוון שמדובר במספר גדול מדי להבנתו, קל יותר לחשוב במונחים של מולקולות בודדות בעת איזון. היו מודעים לכך בעת ההתחלה.
