Une formule chimique est une notation standard simplifiée pour expliquer une réaction chimique utilisée dans les expériences. Ils peuvent sembler compliqués, mais lorsque vous apprenez à les lire, ils deviennent assez explicites.
Regardez la réaction chimique que vous essayez de décomposer sous forme d'équation. Recherchez les mots clés, en particulier les composants chimiques impliqués. Par exemple, le méthane (CH4) est brûlé, ce qui signifie toujours qu'il est fait dans l'oxygène (O2). Cela produit à la fois du dioxyde de carbone (CO2) et de la vapeur d'eau (H2O). Notez l'emplacement du mot « rendements », car c'est important.
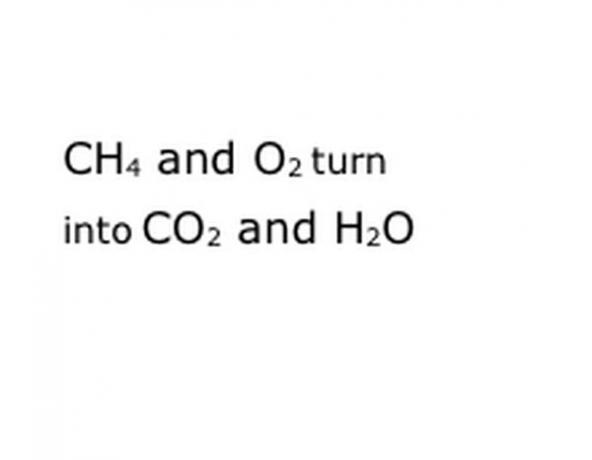
Écrivez les composants chimiques de la réaction dans le format de notation standard. Dans notre exemple, il s'agira de CH4, O2, CO2 et H2O. En chimie, "donner" signifie que tout ce qui est avant se transforme en tout ce qui vient après, alors assurez-vous que "rendement" est à peu près au milieu. Cette phrase représentera la réaction chimique réelle, dans ce cas la combustion. Donc, tout ce que vous brûlerez doit être avant, et tout ce que la réaction produit doit être après.
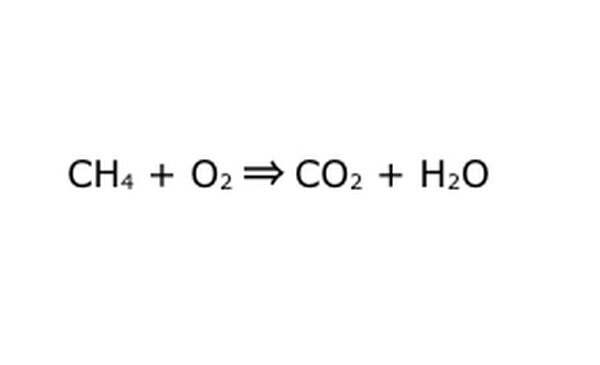
Réécrivez l'équation comme un processus mathématique. Remplacez "rendement" ou "se transforme en" par une flèche et tracez des signes plus entre les composants chimiques. Pour simplifier les choses, pensez à chaque composant chimique comme une molécule individuelle. Il peut être utile de dessiner les molécules sur un morceau de papier brouillon. Assurez-vous que toutes les molécules qui entrent sont représentées en sortant. S'il manque quelque chose dans le produit final, vous pouvez l'ajouter d'une manière qui a du sens - vérifiez tout par rapport à ce que vous savez sur la liaison covalente. Comme la plupart des expériences sont effectuées dans l'atmosphère normale, vous pouvez ajouter de l'O2 si nécessaire aux réactions de combustion. Si l'équation est réversible, assurez-vous qu'elle a une double flèche pour le représenter.
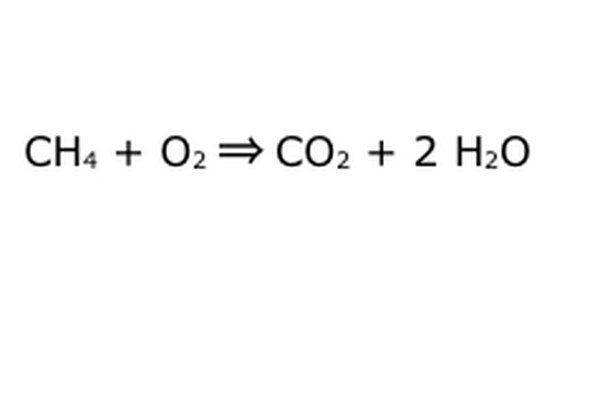
Équilibrez votre équation. C'est là que la loi de conservation entre en jeu: pensez à la flèche, notre réaction, comme à une machine dans laquelle vous avez déversé tous les composants de gauche. La machine ne fabriquera ni n'ajoutera rien que vous n'ayez pas mis, et par conséquent, elle ne recrachera que la même quantité de choses que vous avez mises dedans. À ce moment précis, nous avons deux molécules d'hydrogène en excès qui flottent, car vous mettez "4". Le seul endroit où il peut aller dans cette machine est dans l'un des produits, il devra donc aller dans les molécules d'eau. Écrivez un « 2 » devant le H2O pour indiquer que pour chaque CH4 que vous mettez, vous récupérerez deux H2O.

Notez qu'il y a encore un petit problème avec notre équation: il n'y a pas assez d'oxygène entrant. Il y a quatre atomes d'oxygène qui sortent, mais seulement deux qui entrent, et donc l'ensemble est toujours déséquilibré. Écrivez un "2" devant l'O2 pour indiquer que vous devez mettre deux O2 pour obtenir suffisamment de la réaction.
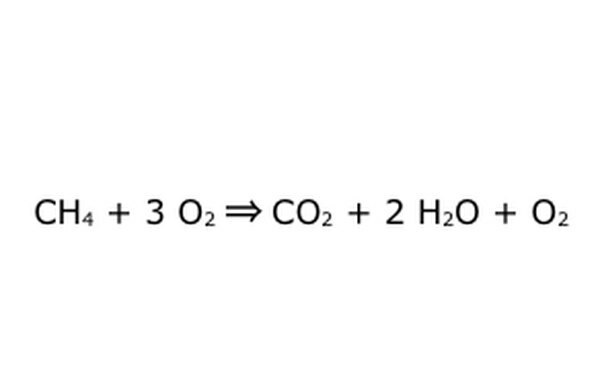
Notez qu'il est possible de faire un processus comme celui-ci "dans un excès d'oxygène". Cela signifie que l'équation met plus d'oxygène que nécessaire et en récupère plus. Pour l'exemple, notez qu'il y a un O2 supplémentaire qui entre, donc il y a un extra qui sort. Assurez-vous simplement que la loi de conservation est respectée à tout moment. Tout ce qui entre doit sortir.
Conseils
Généralement, les produits chimiques dans ces types d'équations sont mesurés en moles. Une mole est une unité qui représente 6,0221415 10^(23) molécules. Comme il s'agit d'un nombre beaucoup trop grand pour être compris, il est plus facile de penser en termes de molécules individuelles lors de l'équilibrage. Soyez-en conscient au démarrage.
