La cinétique est la branche de la chimie physique qui étudie la vitesse des réactions chimiques. En revanche, la thermodynamique nous dit quelle direction de la réaction est favorisée, sans révéler sa vitesse de réaction. Certaines réactions peuvent être favorisées thermodynamiquement mais cinétiquement défavorisées.
Par exemple, dans la conversion du diamant en graphite, le graphite a une énergie libre inférieure à celle du diamant, de sorte que la conversion est thermodynamiquement favorisée. Cependant, il existe une grande barrière d'activation pour que le diamant brise et reforme tous les liens au plus configuration de graphite stable, donc cette réaction est cinétiquement défavorable et ne se produira pas réellement.
Vitesse de réaction
le vitesse de réaction est une mesure de la vitesse à laquelle les produits se forment et les réactifs sont consommés, vous pouvez donc le déterminer en mesurant le changement de concentration des produits ou des réactifs, sur une période de temps. Considérons une réaction chimique générale :
aA + bB > cC + dD
La vitesse de réaction peut s'écrire :
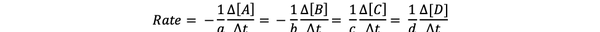
•••Modifié de https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
Par exemple la vitesse de réaction pour :
2 NO(g) + 2 H2 (g) > N2(g) + 2H2O(g)
est donné par
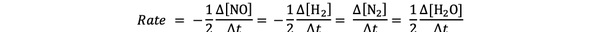
•••Adapté de https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
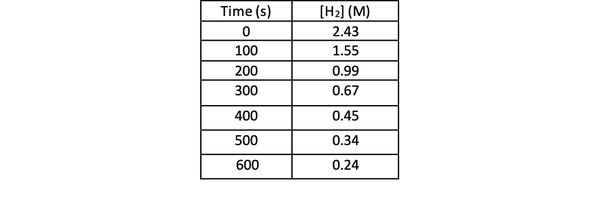
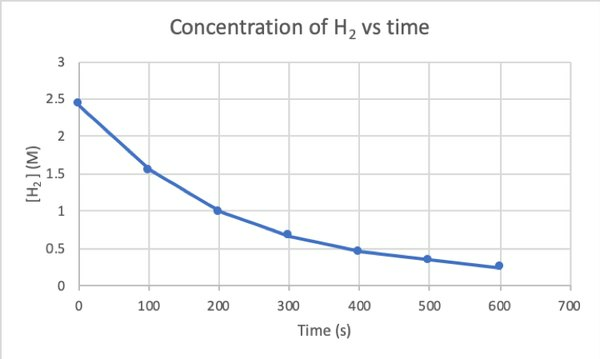
Pour déterminer la vitesse de cette réaction par expérience, vous pouvez mesurer la concentration de H2 à différents moments de la réaction, et tracez-la en fonction du temps comme suit :
•••Modifié de https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
•••Modifié de https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
le vitesse moyenne de réaction est une approximation de la vitesse de réaction dans un intervalle de temps et peut être noté par :
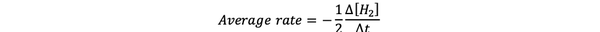
•••Modifié de https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
le vitesse de réaction instantanée est défini comme la vitesse de réaction à un moment donné. Il s'agit d'un taux différentiel et peut s'exprimer par :
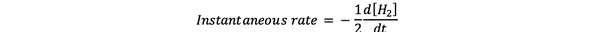
•••Modifié de https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
Où d[H2]/dt est la pente de la courbe de concentration de H2 en fonction du temps au temps t.
le vitesse de réaction initiale est la vitesse instantanée au début de la réaction, lorsque t = 0. Dans ce cas, le unité car la vitesse de réaction moyenne, instantanée et initiale est M/s.
Loi sur les taux
Dans la plupart des cas, la vitesse de réaction dépend de la concentration des différents réactifs à l'instant t. Par exemple, dans une concentration plus élevée de tous les réactifs, les réactifs entrent en collision plus fréquemment et entraînent une réaction plus rapide. La relation entre la vitesse de réaction (t) et les concentrations est définie comme la loi sur les taux. Et la loi de vitesse pour la réaction chimique générale aA + bB > cC + dD est :
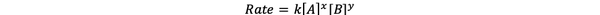
•••Modifié de https://chem.libretexts.org/Bookshelves/Ancillary_Materials/Laboratory_Experiments/Wet_Lab_Experiments/General_Chemistry_Labs/Online_Chemistry_Lab_Manual/Chem_12_Experiments/01%3A_Chemical_Kinetics_-_The_Method_of_Initial_Rates_(Experiment)
Où k est la constante de vitesse, et la puissance x et y est la ordre de la réaction par rapport aux réactifs A et B. La loi de vitesse doit être déterminée expérimentalement et ne peut être déduite de la seule stoechiométrie d'une réaction chimique équilibrée.
Méthode des taux initiaux
La loi de taux peut être déterminée par le méthode des taux initiaux. Dans cette méthode, l'expérience est effectuée plusieurs fois, en ne modifiant que la concentration d'un réactif pour chaque essai tout en gardant les autres variables constantes. La vitesse de la réaction est mesurée pour chaque essai afin de déterminer l'ordre de chaque réactif dans la loi de vitesse.
Par exemple, considérons les données de taux initiales suivantes pour la réaction :
2 NO(g) + 2 H2 (g) > N2(g) + 2H2O(g)
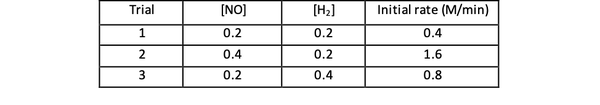
•••Adapté de https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
Pour les essais 1 et 3, la concentration de NO est maintenue constante tandis que la concentration de H2 est doublé. En conséquence, la vitesse de réaction initiale a également doublé (pensez-y comme 21), vous pouvez donc conclure y = 1. Pour les essais 1 et 2, la concentration de NO est doublée tandis que la concentration de H2 reste constant. Le résultat de ce changement est que le taux initial a quadruplé (pensez-y comme 22). Vous pouvez donc conclure x = 2.
La loi de vitesse de cette réaction est donc :
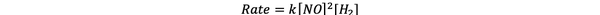
•••Adapté de https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
Et la réaction est Premier ordre en H2 et deuxième ordre dans NON.
