Kinetiikka on fysikaalisen kemian haara, joka tutkii kemiallisten reaktioiden nopeutta. Sitä vastoin termodynamiikka kertoo meille, mikä reaktion suunta on suotuisa, paljastamatta sen reaktionopeutta. Joitakin reaktioita voidaan suosia termodynaamisesti, mutta kineettisesti.
Esimerkiksi timantin muuntamisessa grafiitiksi grafiitilla on pienempi vapaa energia kuin timantilla, joten muuntamista suositaan termodynaamisesti. Timantilla on kuitenkin suuri aktivoinnin este murtamaan ja uudistamaan kaikki sidokset entistä enemmän vakaa grafiittikokoonpano, joten tämä reaktio on kineettisesti epäedullinen eikä sitä todellakaan tapahdu.
Reaktionopeus
reaktionopeus on mitta siitä, kuinka nopeasti tuotteet muodostuvat ja reagoivat aineet kulutetaan, joten voit määrittää sen mittaamalla tuotteiden tai reagoivien aineiden pitoisuuden muutoksen tietyn ajanjakson aikana. Harkitse yleistä kemiallista reaktiota:
aA + bB> cC + dD
Reaktionopeus voidaan kirjoittaa seuraavasti:
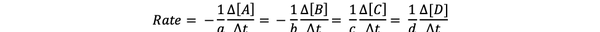
•••Muokattu https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
Esimerkiksi reaktionopeus:
2 NO (g) + 2 H2 (g)> N2(g) + 2H2O (g)
antaa
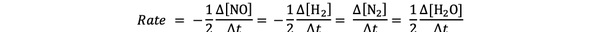
•••Mukautettu https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
Tämän reaktion nopeuden määrittämiseksi kokeilla voit mitata H-pitoisuutta2 reaktion eri aikoina ja piirrä se ajan suhteen seuraavasti:
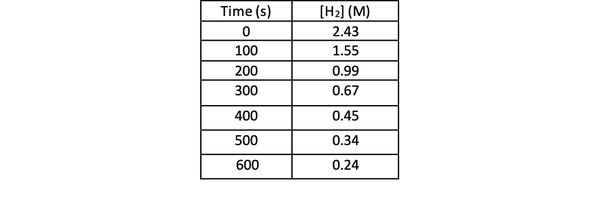
•••Muokattu https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
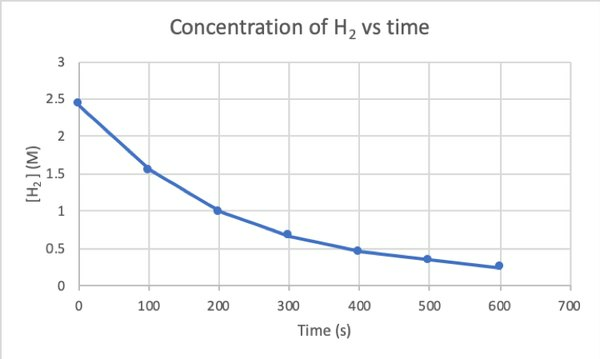
•••Muokattu https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
keskimääräinen reaktionopeus on arvio reaktionopeudesta aikavälillä ja voidaan merkitä seuraavasti:
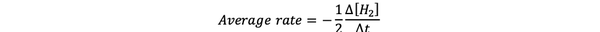
•••Muokattu https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
hetkellinen reaktionopeus Määritellään reaktionopeudeksi jossakin hetkessä. Se on ero ja se voidaan ilmaista:
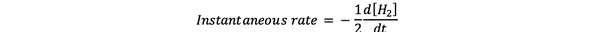
•••Muokattu https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
Missä d [H2] / dt on H: n pitoisuuskäyrän kaltevuus2 vs. aika ajankohtana t.
alkureaktion nopeus on hetkellinen nopeus reaktion alussa, kun t = 0. Tässä tapauksessa yksikkö keskimääräiselle, hetkelliselle ja alkureaktionopeudelle on M / s.
Korkolaki
Useimmissa tapauksissa reaktionopeus riippuu eri reagenssien pitoisuudesta hetkellä t. Esimerkiksi kaikkien reaktanttien korkeammassa konsentraatiossa reaktantit törmäävät useammin ja johtavat nopeammin reaktioon. Reaktionopeuden ν (t) ja pitoisuuksien välinen suhde määritellään korolaki. Ja yleisen kemiallisen reaktion aA + bB> cC + dD nopeuslaki on:
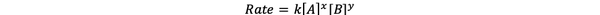
•••Muokattu https://chem.libretexts.org/Bookshelves/Ancillary_Materials/Laboratory_Experiments/Wet_Lab_Experiments/General_Chemistry_Labs/Online_Chemistry_Lab_Manual/Chem_12_Experiments/01%3A_Chemical_Kinetics_-_The_Method_of_Initial_Rates_(Experiment)
Missä k on nopeusvakio ja teho x ja y on Tilaus reaktion reagoivasta aineesta A ja B. Nopeuslaki on määritettävä kokeellisesti, eikä sitä voida päätellä pelkästään tasapainotetun kemiallisen reaktion stökiometrian perusteella.
Alkuperäisten hintojen menetelmä
Korkolaki voidaan määrittää menetelmä alkuperäisiin korkoihin. Tässä menetelmässä koe suoritetaan useita kertoja muuttamalla vain yhden reaktantin konsentraatiota kutakin ajoa varten pitäen muut muuttujat vakioina. Reaktionopeus mitataan kullekin ajolle kunkin reagenssin järjestyksen määrittämiseksi nopeuslaissa.
Harkitse esimerkiksi seuraavia reaktion alkuperäisiä nopeustietoja:
2 NO (g) + 2 H2 (g)> N2(g) + 2H2O (g)
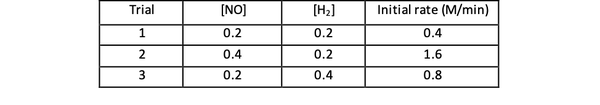
•••Mukautettu https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
Kokeissa 1 ja 3 NO-pitoisuus pidetään vakiona samalla kun H-pitoisuus2 kaksinkertaistuu. Tämän seurauksena myös alkuperäinen reaktionopeus kaksinkertaistui (ajattele sitä 21), joten voit päätellä y = 1. Kokeissa 1 ja 2 NO: n pitoisuus kaksinkertaistuu samalla kun H: n pitoisuus2 pysyy vakiona. Tämän muutoksen seurauksena alkuperäinen korko nelinkertaistui (ajattele sitä 22). Voit siis päätellä x = 2.
Tämän reaktion nopeuslaki on siis:
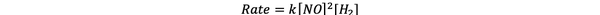
•••Mukautettu https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
Ja reaktio on ensimmäinen tilaus julkaisussa H2 ja toinen tilaus julkaisussa NO.
