الكربون عنصر غير فلزي برمز كيميائي لـ C. إنه رابع أكثر العناصر وفرة في الكون ، والعنصر الخامس عشر الأكثر وفرة في قشرة الأرض. كما أنه ثاني أكثر العناصر وفرة في البشر بعد الأكسجين. يؤدي تركيبته الكيميائية إلى العديد من الخصائص الفريدة للكربون.
ينتمي الكربون إلى المجموعة 14 من الجدول الدوري. عددها الذري 6 ووزنها الذري 12.011. يمكن أن تختلف حالات أكسدة الكربون من -4 إلى +4 ، حيث يوجد +4 في مركبات مثل الميثان وثاني كبريتيد الكربون ، و +2 لأول أكسيد الكربون.
تجعل الخصائص الفيزيائية لخواص الكربون المختلفة مفيدة في البطاريات والإلكترونيات والمواد النانوية. الكربون هو أيضًا "ملك العناصر" ، ويتشكل تقريبًا 10 مليون كمبوند حتى الآن بما في ذلك المركبات العضوية وغير العضوية والمعدنية العضوية.
تُستخدم نظائر الكربون على نطاق واسع في التأريخ بالكربون المشع (الكربون 14) والتركيب الجزيئي والأبحاث الطبية (الكربون -13) بالإضافة إلى ذلك ، تُظهر ألياف الكربون خصائص ميكانيكية ممتازة وتحظى بشعبية في مجال الطيران والهندسة المدنية.
Allotropes من الكربون
الكربون مختلف أشكال متآصلة، مع التكوينات الجزيئية والتركيبات الذرية المتنوعة. تختلف الخصائص الفيزيائية للكربون اختلافًا كبيرًا مع كل متآصل. بعض من أكثر المتآصلات المعروفة للكربون تشمل الجرافيت والماس والفوليرين.
يعد الجرافيت من أنعم المواد المعروفة ويستخدم في أقلام الرصاص وكمواد تشحيم صلبة. كما أنه موصل جيد للكهرباء مما يجعله مفيدًا في البطاريات والألواح الشمسية.
الجرافين هو ببساطة طبقة ذرية واحدة من الجرافيت مرتبة في شبكة قرص العسل. في طبقة الجرافين ، يتم ربط كل ذرة كربون تساهميًا بثلاث ذرات أخرى ، مما يترك الإلكترون الرابع حراً لينتقل في المستوى ، ومن ثم توصيله الكهربائي.
الماس ، على العكس من ذلك ، هو أصعب مادة طبيعية وهو أحد الخصائص الفريدة للكربون. لديها ما يقرب من ضعف كثافة الجرافيت ، وكل ذرة كربون مرتبطة رباعي السطوح بأربع أخرى بدون إلكترونات تتدفق بحرية. وبالتالي الماس موصل ضعيف للكهرباء. الماس واضح في المظهر أيضًا ، على عكس الجرافيت ، وهو معتم.
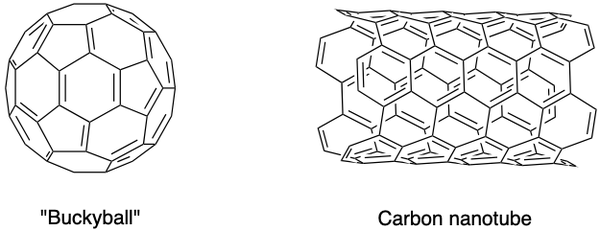
قام العلماء أيضًا بتصنيع تآصلات أخرى من الكربون ، مثل الفوليرين ، والرغوة النانوية الكربونية وغيرها. يمتلكون خصائص خاصة ويشكلون مجالًا مزدهرًا للبحث في المواد النانوية. الفوليرين عبارة عن مجموعة من جزيئات الكربون المجوفة في شكل قفص مغلق (كرة بوكي) أو أسطوانة (أنابيب نانوية كربونية).
•••تم إنشاؤه باستخدام ChemDraw
سي60 تم اكتشاف كرة بوكي بواسطة السير هارولد كروتو وريتشارد سمالي وروبرت كورل جونيور ، باستخدام الليزر لتبخير قضبان الجرافيت في جو الهيليوم. يتم ربط ذرات الكربون معًا بواسطة روابط مفردة ومزدوجة لتشكيل 12 وجهًا خماسيًا و 20 وجهًا سداسيًا على شكل كرة قدم. أكسبتهم جهودهم الرائدة جائزة نوبل في عام 1996.
تم تحديد الأنابيب النانوية الكربونية ، وهي نسخ مطولة من كرات بوكي ، بواسطة Iijima Sumio. إنها موصلات ممتازة للحرارة والكهرباء ومفيدة للإلكترونيات.
تُظهر الأنابيب النانوية الكربونية أيضًا قوة شد رائعة ولها تطبيقات مثيرة في المواد الإنشائية والطب. ومع ذلك ، فإن التوليف الخاضع للرقابة لمثل هذه المواد النانوية قد شكل تحديًا كبيرًا للعلماء.
التفاعل الكيميائي للكربون
يشكل الكربون أساس الحياة على الأرض ، حيث تشكل الملايين من المركبات المحتوية على الكربون 18٪ من جميع الكائنات الحية. يمكن أن تشكل روابط تساهمية مستقرة مع ذرات أخرى وتظهر كسلاسل طويلة أو حلقات من روابط قوية بين الكربون والكربون. تساهم هذه في تنوع وتعقيد مركبات الكربون الموجودة على الأرض.
هؤلاء مركبات الكربون تشمل الجزيئات العضوية مثل البروتينات والكربوهيدرات والحمض النووي الموجود في خلايا الكائنات الحية وكذلك المركبات غير العضوية مثل أكاسيد الكربون. تشكل دراسة الجزيئات العضوية مجالًا متخصصًا يسمى الكيمياء العضوية. يمكن للكربون أيضًا تكوين روابط تساهمية مع المعدن كمركبات عضوية معدنية. ومن الأمثلة على ذلك بورفيرين الحديد ، وهو موقع ارتباط الأكسجين بالهيموجلوبين.
على الرغم من وفرة الكربون في الطبيعة ، إلا أنه غير متفاعل نسبيًا في ظل الظروف العادية. عند درجة الحرارة القياسية ، لا يتفاعل مع الأحماض (حمض الكبريتيك أو حمض الهيدروكلوريك) أو القلويات. كما أنه مستقر للأكسدة عند درجة الحرارة هذه. ومع ذلك ، في درجات الحرارة المرتفعة ، يمكن أن يتفاعل الكربون مع الأكسجين لتكوين أكاسيد الكربون (CO2 و CO) ، مع غاز الكبريت لتكوين ثاني كبريتيد الكربون والسيليكون لتكوين الكربيدات.
نظائر الكربون
هناك 15 نظيرًا معروفًا للكربون ، منها الكربون -12 (98.93٪ من الكربون الطبيعي) والكربون -13 (1.07٪) هما النظيران المستقران. الكربون 14 هو النظير الأطول عمرا ، حيث يبلغ نصف العمر 5730 سنة. أقصر نظير الكربون عمرا هو الكربون 8 ، وله نصف عمر 1.98739 × 10−21 ثواني.
يتم تمثيل نظير الكربون 14 بواسطة 146C ، حيث يمثل الرمز 14 الكتلة الذرية بينما يمثل الرمز 6 هو العدد الذري. يحتوي الكربون 14 على وفرة طبيعية منخفضة جدًا (0.0000000001 بالمائة) ، لكن نصف عمره الطويل يجعله مفيدًا التأريخ الإشعاعي.
يتكون الكربون 14 عندما يتفاعل النيتروجين -14 مع نيوترونات الإشعاع الكوني ، ويطلق بروتونًا في هذه العملية. ثم يتفاعل الكربون -14 مع الأكسجين لتوليدها 14كو2، والتي يتم توزيعها بالتساوي في الغلاف الجوي مع 12كو2.
147N + 10ن> 146ج + 11ص
تبدأ دورة الكربون عندما تقوم الكائنات الحية بتحويل ثاني أكسيد الكربون (14كو2 و 12كو2 من الغلاف الجوي) إلى مركبات عضوية عن طريق التمثيل الضوئي وإعادتها إلى الغلاف الجوي عن طريق التنفس. في هذا التوازن ، توجد نسبة ثابتة من 14كو2 و 12كو2 في الكائنات الحية. ومع ذلك ، عندما يموتون ، يتوقف التوازن ، ويخضع الكربون 14 لاضمحلال بيتا إلى النيتروجين -14 وفقًا لنصف العمر البالغ 5،730 عامًا.
146ج> 147N + 0-1ه
يسمح قياس النسبة النسبية للكربون 14 في عينة ميتة بحساب الوقت المنقضي بعد وفاته. تم استخدام طريقة التأريخ بالكربون المشع على نطاق واسع لتأريخ الحفريات والعينات الأثرية من 500 إلى 50000 عام.
الكربون 13 هو نظير آخر يستخدم على نطاق واسع في العديد من التطبيقات. على سبيل المثال ، يتم استخدامه في الرنين المغناطيسي النووي (NMR) لتحديد الهياكل الجزيئية للمركبات العضوية. كما أنها تستخدم كأداة لوضع العلامات بالاشتراك مع مطياف الكتلة للأبحاث الطبية.
الخواص الميكانيكية لألياف الكربون
يُظهر الكربون أيضًا خصائص ميكانيكية مفيدة ، بخلاف خواصه الفيزيائية والكيميائية والنووية.
يمكن أن تتشكل سبائك من الفولاذ إلى صلب الكربون ، والتي يتراوح محتوى الكربون منها من 0.05 إلى 2 في المائة من حيث الوزن. يتمتع الفولاذ الكربوني المتوسط (0.3-0.6 في المائة من الكربون) بقوة متوازنة وليونة ، فضلاً عن قوة شد ممتازة. من خلال عملية المعالجة الحرارية ، يمكن تلطيف الفولاذ عالي الكربون (1.25-2٪ كربون) إلى صلابة كبيرة واستخدامه في صناعة السكاكين.
تُظهر ألياف الكربون ، التي يتراوح سمكها من 5 إلى 10 ميكرومتر وتتكون في الغالب من ذرات الكربون ، أنها عالية الصلابة وقوة الشد والمقاومة الكيميائية وتحمل درجة الحرارة وانخفاض الوزن والحرارة توسع. تعتمد قوة الخضوع للفولاذ على درجته ، ويبلغ قوة الخضوع للفولاذ الطري 247 ميجا باسكال. ألياف الكربون لها تتراوح قوة الشد من 1600 إلى 6370 ميجا باسكال ، وبالتالي فهي تحظى بشعبية في مجال الطيران والهندسة المدنية و رياضات.
عندما يتم ممارسة ضغط على مادة ، فإنها تتشوه بشكل مرن في البداية. في هذه المرحلة ، يمكن أن يعود إلى شكله الأصلي عند إزالة الضغط. قوة الغلة يُعرَّف بأنه الضغط الذي يمكن أن تتحمله المادة دون تشوه دائم.
عندما يصل إلى نقطة (أعلى نقطة إنتاجية) حيث لم يعد بإمكانه العودة إلى أبعاده الأصلية ، فإنه يخضع لتشوه بلاستيكي ، وهو دائم ولا رجعة فيه. قوة الشد هي أقصى قوة يمكن للمادة أن تتحملها دون أن تتعطل أو تنكسر.
