คุณอาจเคยเจอแบตเตอรีกำลังจะหมด ซึ่งเป็นเรื่องน่ารำคาญหากคุณพยายามใช้แบตเตอรี่เหล่านี้ในอุปกรณ์อิเล็กทรอนิกส์ คุณสมบัติทางเคมีของเซลล์ของแบตเตอรี่สามารถบอกคุณถึงคุณสมบัติเกี่ยวกับวิธีการทำงานของแบตเตอรี่ รวมถึงวิธีที่แบตเตอรี่หมด
เซลล์เคมีของแบตเตอรี่
•••Syed Hussain Ather A
เมื่อปฏิกิริยาไฟฟ้าเคมีของแบตเตอรี่ทำให้วัสดุหมดลง แบตเตอรี่ก็จะแบน โดยทั่วไปจะเกิดขึ้นหลังจากใช้งานแบตเตอรี่เป็นเวลานาน
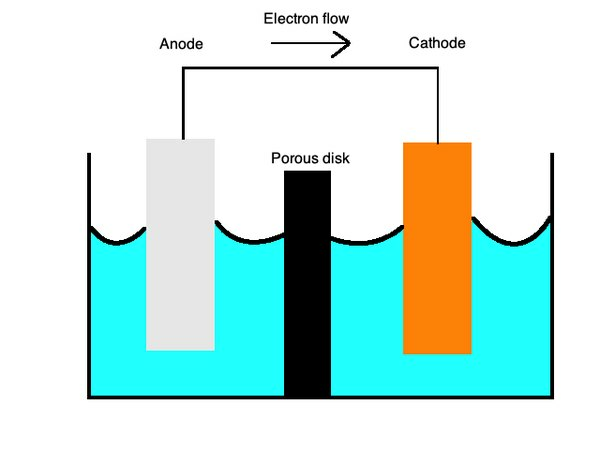
โดยทั่วไปแบตเตอรี่จะใช้เซลล์ปฐมภูมิ ซึ่งเป็นชนิดของเซลล์กัลวานิกที่ใช้โลหะสองชนิดที่แตกต่างกันในอิเล็กโทรไลต์เหลวเพื่อให้สามารถถ่ายเทประจุระหว่างกันได้ ประจุบวกไหลจากแคโทดสร้างขึ้นด้วยไพเพอร์หรือไอออนที่มีประจุบวก เช่น ทองแดง สู่ขั้วบวกที่มีประจุลบหรือประจุลบ เช่น สังกะสี
เคล็ดลับ
แบตเตอรี่หมดเกลี้ยงเนื่องจากสารเคมีของอิเล็กโทรไลต์แห้งภายในแบตเตอรี่ ในกรณีของแบตเตอรี่อัลคาไลน์ นี่คือเมื่อมีการแปลงแมงกานีสไดออกไซด์ทั้งหมดแล้ว ในขั้นตอนนี้แบตเตอรี่จะแบน
เพื่อจดจำความสัมพันธ์นี้ คุณสามารถจำคำว่า "OILRIG" ได้ สิ่งนี้บอกคุณว่าออกซิเดชันคือการสูญเสีย(“น้ำมัน”) และการลดลงคือกำไร(“RIG”) ของอิเล็กตรอน ดิช่วยในการจำสำหรับแอโนดและแคโทด
เซลล์ปฐมภูมิยังสามารถทำงานกับโลหะครึ่งเซลล์แต่ละครึ่งเซลล์ในสารละลายไอออนิกที่เชื่อมต่อด้วยสะพานเกลือหรือเมมเบรนที่มีรูพรุน เซลล์เหล่านี้ให้แบตเตอรี่ที่มีประโยชน์มากมาย
แบตเตอรี่อัลคาไลน์ซึ่งใช้ปฏิกิริยาระหว่างแอโนดสังกะสีกับแมกนีเซียมแคโทดโดยเฉพาะ ใช้สำหรับไฟฉาย อุปกรณ์อิเล็กทรอนิกส์แบบพกพา และรีโมทคอนโทรล ตัวอย่างอื่นๆ ขององค์ประกอบแบตเตอรี่ยอดนิยม ได้แก่ ลิเธียม ปรอท ซิลิคอน ซิลเวอร์ออกไซด์ กรดโครมิก และคาร์บอน
การออกแบบทางวิศวกรรมสามารถใช้ประโยชน์จากแบตเตอรี่ที่แบนราบเพื่อประหยัดพลังงานและนำกลับมาใช้ใหม่ได้ แบตเตอรี่ในครัวเรือนราคาประหยัดมักใช้เซลล์คาร์บอน-สังกะสีที่ออกแบบมาให้หากสังกะสีผ่านการกัดกร่อนด้วยไฟฟ้าซึ่งเป็นกระบวนการที่โลหะกัดกร่อนโดยเฉพาะอย่างยิ่ง แบตเตอรี่อาจผลิตกระแสไฟฟ้าโดยเป็นส่วนหนึ่งของวงจรอิเล็กตรอนแบบปิด
แบตเตอรี่ระเบิดที่อุณหภูมิเท่าไหร่? คุณสมบัติทางเคมีของเซลล์ของแบตเตอรี่ลิเธียมไอออนทำให้แบตเตอรี่เหล่านี้เริ่มปฏิกิริยาเคมีซึ่งส่งผลให้เกิดการระเบิดที่อุณหภูมิประมาณ 1,000 °C วัสดุทองแดงที่อยู่ภายในละลายซึ่งทำให้แกนภายในแตก
ประวัติเซลล์เคมี
ในปี 1836 นักเคมีชาวอังกฤษ John Frederic Daniell ได้สร้างแดเนียล เซลล์ซึ่งเขาใช้อิเล็กโทรไลต์สองชนิด แทนที่จะใช้เพียงอันเดียว เพื่อให้ไฮโดรเจนที่ผลิตขึ้นโดยตัวหนึ่งและอีกตัวหนึ่งบริโภคเข้าไป เขาใช้สังกะสีซัลเฟตแทนกรดซัลฟิวริก ซึ่งเป็นวิธีปฏิบัติทั่วไปของแบตเตอรี่ในสมัยนั้น
ก่อนหน้านั้น นักวิทยาศาสตร์ใช้เซลล์โวลตาอิก ซึ่งเป็นเซลล์เคมีชนิดหนึ่งที่ใช้ปฏิกิริยาที่เกิดขึ้นเอง ซึ่งสูญเสียพลังงานในอัตราที่รวดเร็ว แดเนียลใช้แผงกั้นระหว่างแผ่นทองแดงและสังกะสีเพื่อป้องกันไม่ให้ไฮโดรเจนส่วนเกินเกิดฟอง และหยุดแบตเตอรี่ไม่ให้เสื่อมสภาพอย่างรวดเร็ว งานของเขาจะนำไปสู่นวัตกรรมด้านโทรเลขและโลหะวิทยาไฟฟ้า ซึ่งเป็นวิธีการใช้พลังงานไฟฟ้าในการผลิตโลหะ
แบตเตอรี่แบบชาร์จได้จะแบนได้อย่างไร
เซลล์รองในทางกลับกัน สามารถชาร์จไฟได้ แบตเตอรี่แบบชาร์จไฟได้หรือที่เรียกว่าแบตเตอรี่สำหรับจัดเก็บ เซลล์ทุติยภูมิหรือตัวสะสม จะเก็บประจุตามเวลาที่แคโทดและแอโนดเชื่อมต่อกันในวงจร
เมื่อชาร์จ โลหะแอคทีฟที่เป็นบวก เช่น นิกเกิลออกไซด์ไฮดรอกไซด์ จะถูกออกซิไดซ์ ทำให้เกิดอิเล็กตรอน และสูญเสียไปในขณะที่วัสดุเชิงลบเช่นแคดเมียมจะลดลงจับอิเล็กตรอนและรับ พวกเขา แบตเตอรี่ใช้รอบการชาร์จ-คายประจุโดยใช้แหล่งต่างๆ รวมถึงไฟฟ้ากระแสสลับเป็นแหล่งกำเนิดแรงดันไฟฟ้าภายนอก
แบตเตอรี่แบบชาร์จไฟได้ยังคงแบนได้หลังจากใช้งานซ้ำๆ เนื่องจากวัสดุที่เกี่ยวข้องกับปฏิกิริยาสูญเสียความสามารถในการชาร์จและชาร์จซ้ำ เนื่องจากระบบแบตเตอรี่เหล่านี้เสื่อมสภาพ จึงมีวิธีที่แบตเตอรี่จะแบนได้หลายวิธี
เนื่องจากมีการใช้งานแบตเตอรี่เป็นประจำ แบตเตอรี่บางชนิด เช่น แบตเตอรี่ตะกั่ว-กรด อาจสูญเสียความสามารถในการชาร์จใหม่ ลิเธียมของแบตเตอรี่ลิเธียมไอออนอาจกลายเป็นโลหะลิเธียมที่ทำปฏิกิริยาซึ่งไม่สามารถกลับเข้าสู่รอบการคายประจุอีกครั้งได้ แบตเตอรี่ที่มีอิเล็กโทรไลต์เหลวอาจมีความชื้นลดลงเนื่องจากการระเหยหรือการชาร์จมากเกินไป
การใช้งานแบตเตอรี่แบบชาร์จไฟได้
โดยทั่วไปจะใช้แบตเตอรี่เหล่านี้ในการสตาร์ทรถยนต์ รถเข็น จักรยานไฟฟ้า เครื่องมือไฟฟ้า และสถานีเก็บแบตเตอรี่ นักวิทยาศาสตร์และวิศวกรได้ศึกษาการใช้งานในยานยนต์ระบบเผาไหม้ภายในแบบไฮบริดและรถยนต์ไฟฟ้าเพื่อให้มีประสิทธิผลมากขึ้นในการใช้พลังงานและมีอายุการใช้งานยาวนานขึ้น
แบตเตอรี่ตะกั่วกรดแบบชาร์จได้จะทำลายโมเลกุลของน้ำ (โฮ2อู๋) ลงในสารละลายไฮโดรเจนที่เป็นน้ำ (โฮ+) และออกไซด์ไอออน (อู๋2-) ซึ่งผลิตพลังงานไฟฟ้าจากพันธะที่ขาดเมื่อน้ำสูญเสียประจุ เมื่อสารละลายไฮโดรเจนในน้ำทำปฏิกิริยากับไอออนออกไซด์เหล่านี้ พันธะ O-H ที่แรงจะถูกนำมาใช้เพื่อให้พลังงานแก่แบตเตอรี่
ฟิสิกส์ของปฏิกิริยาแบตเตอรี่
พลังงานเคมีนี้ให้พลังงานแก่ปฏิกิริยารีดอกซ์ที่เปลี่ยนสารตั้งต้นที่มีพลังงานสูงเป็นผลิตภัณฑ์ที่มีพลังงานต่ำ ความแตกต่างระหว่างสารตั้งต้นและผลิตภัณฑ์ทำให้เกิดปฏิกิริยาและสร้างวงจรไฟฟ้าเมื่อเชื่อมต่อแบตเตอรี่โดยการแปลงพลังงานเคมีเป็นพลังงานไฟฟ้า
ในเซลล์กัลวานิก สารตั้งต้น เช่น สังกะสีโลหะ มีพลังงานอิสระสูง ซึ่งทำให้ปฏิกิริยาเกิดขึ้นเองตามธรรมชาติโดยไม่มีแรงจากภายนอก
โลหะที่ใช้ในขั้วบวกและแคโทดมีพลังงานยึดเหนี่ยวขัดแตะซึ่งสามารถขับเคลื่อนปฏิกิริยาเคมีได้ พลังงานประสานขัดแตะเป็นพลังงานที่จำเป็นในการแยกอะตอมที่ทำให้โลหะออกจากกัน โลหะสังกะสี แคดเมียม ลิเธียม และโซเดียม มักใช้เพราะมีพลังงานไอออไนเซชันสูง ซึ่งเป็นพลังงานขั้นต่ำที่จำเป็นในการกำจัดอิเล็กตรอนออกจากองค์ประกอบ
เซลล์กัลวานิกที่ขับเคลื่อนด้วยไอออนของโลหะชนิดเดียวกันสามารถใช้ความแตกต่างของพลังงานอิสระเพื่อทำให้พลังงานอิสระของกิ๊บส์ขับเคลื่อนปฏิกิริยา ดิกิ๊บส์พลังงานฟรีเป็นพลังงานอีกรูปแบบหนึ่งที่ใช้ในการคำนวณปริมาณงานที่กระบวนการทางอุณหพลศาสตร์ใช้
ในกรณีนี้ การเปลี่ยนแปลงมาตรฐาน Gibbs free energyGo ขับเคลื่อนแรงดันไฟฟ้าหรือแรงเคลื่อนไฟฟ้าอีoเป็นโวลต์ตามสมการ
E^{\text{o}}=\frac{-\Delta_rG^{\text{o}}}{v_eF}
ซึ่งในวีอีคือจำนวนอิเล็กตรอนที่ถ่ายโอนระหว่างปฏิกิริยาและ F คือค่าคงที่ของฟาราเดย์ (F = 96485.33 C mol−1).
ดิΔrGo แสดงว่าสมการใช้การเปลี่ยนแปลงพลังงานกิ๊บส์ฟรี (ΔrGo =Gสุดท้าย - Gเริ่มต้น).เอนโทรปีเพิ่มขึ้นเมื่อปฏิกิริยาใช้พลังงานอิสระที่มีอยู่ ในเซลล์ Daniell ความแตกต่างของพลังงานประสานกันระหว่างสังกะสีและทองแดงทำให้เกิดความแตกต่างของพลังงานอิสระกิ๊บส์ส่วนใหญ่เมื่อเกิดปฏิกิริยาΔrGo= -213 kJ/mol ซึ่งเป็นความแตกต่างของพลังงาน Gibbs ของผลิตภัณฑ์และของสารตั้งต้น
แรงดันของเซลล์กัลวานิก
หากคุณแยกปฏิกิริยาไฟฟ้าเคมีของเซลล์กัลวานิกออกเป็นครึ่งปฏิกิริยาของการเกิดออกซิเดชันและการลดลง กระบวนการ คุณสามารถรวมแรงเคลื่อนไฟฟ้าที่เกี่ยวข้องเพื่อให้ได้ค่าความต่างศักย์ไฟฟ้ารวมที่ใช้ใน เซลล์
ตัวอย่างเช่น เซลล์กัลวานิกทั่วไปอาจใช้ CuSO4 และ ZnSO4 ด้วยปฏิกิริยาครึ่งศักย์มาตรฐานเป็น:Cu2+ + 2 อี− ⇌ Cu⇌ด้วยศักย์ไฟฟ้าที่สอดคล้องกันอีo = +0.34 Vและสังกะสี2+ + 2 อี− ⇌ Znมีศักยภาพอีo = −0.76 V.
สำหรับปฏิกิริยาโดยรวมCu2+ + Zn ⇌ Cu + Zn2+ คุณอาจ "พลิก" สมการครึ่งปฏิกิริยาของสังกะสีในขณะที่พลิกสัญลักษณ์ของแรงเคลื่อนไฟฟ้าเพื่อให้ได้มาสังกะสี ⇌ สังกะสี2+ + 2 อี− กับอีo = 0.76 โวลต์ศักย์ปฏิกิริยาโดยรวม คือ ผลรวมของแรงเคลื่อนไฟฟ้า เท่ากับ+0.34 V − (−0.76 V) = 1.10 V.
