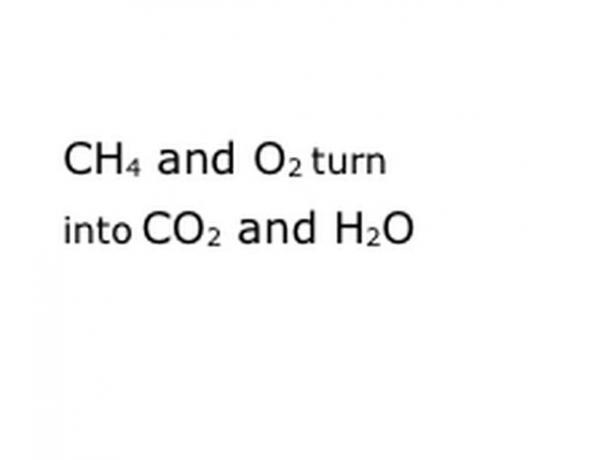
V chémii termín „výťažok“ označuje množstvo produktu alebo produktov, ktoré chemická reakcia vyprodukuje, alebo „výťažok“. Existujú dva typy výnosov: teoretické výnosy a skutočné výnosy. Keď určujete „skutočný“ výťažok reakcie na základe množstva produktu, ktoré ste schopní „izolovať“ z reakčnej komory, niektoré učebnice chémie ho označujú ako „izolovaný výnos“. Porovnajte tento „izolovaný výnos“ s teoretickým výnosom a vypočítajte „percentuálny výnos“ - koľko produktu ste dostali z hľadiska toho, koľko ste očakávali dostať.
Vyvážte svoju chemickú rovnicu tak, že na ľavej strane budete mať rovnaké množstvo každého atómu a na pravej strane rovnaké množstvo. Môžete reprezentovať rozklad tuhého dusičnanu meďnatého, Cu (NO3) 2, na prášok oxidu meďnatého, plynný oxid dusičitý a plynný kyslík, napríklad pomocou nevyváženej rovnice Cu (NO3) 2 -> CuO + NO2 + O2. Najprv si všimnite, že na ľavej strane sú dva dusíky a na pravej iba jeden. Ak to chcete opraviť, pridajte pred „NO2“ koeficient „2“. Spočítajte kyslíky vľavo - je ich šesť - a vpravo - je ich sedem. Pretože môžete použiť iba celočíselné koeficienty, pridajte najmenší („2“) pred Cu (NO3) 2. Pridajte ďalšie „2“ pred „CuO“, aby ste vyvážili meď a opäť počítali kyslíky - na ľavej strane je 12 a na pravej 8. Nezabúdajte, že teraz tiež existujú štyri dusíky. Zmeňte „2“ pred dusíkom na „4“ - vaša rovnica je teraz vyvážená ako 2Cu (NO3) 2 -> 2CuO + 4NO2 + O2.
Vypočítajte hodnoty „molárnej hmotnosti“ svojich reaktantov a produktov. Majte na pamäti, že na účely reakcií s percentuálnym výťažkom sa nebudete musieť vôbec zaoberať plynmi. Pre príklad reakcie potom stačí vypočítať molárne hmotnosti dusičnanu meďnatého a oxidu meďnatého. Použite svoju periodickú tabuľku na stanovenie molekulových hmotností pre Cu (NO3) 2 aj pre CuO v amu - 187,56 amu a 79,55 amu. Ich zodpovedajúce molárne hmotnosti sú 187,56 gramov, respektíve 79,55 gramov.
Určte, s koľkými mólami reaktantu začínate. Pre príklad reakcie si predstavte, že máte 250,04 gramov dusičnanu meďnatého. Túto hmotnosť preveďte na móly nasledovne: 250,04 g Cu (NO3) 2 x (1 mol Cu (NO3) 2 / 187,57 g Cu (NO3) 2) = 1,33 mol Cu (No3) 2.
Vypočítajte, koľko gramov produktu predpokladáte - váš „teoretický výťažok“. Z vyváženej reakcie 2Cu (NO3) 2 -> 2CuO + 4NO2 + O2 si všimnite, že dva móly medi dusičnan by mal poskytnúť dva móly oxidu medi - inými slovami, mali by ste skončiť s rovnakým počtom mólov oxidu meďnatého, ako ste začali s mólmi dusičnanu meďnatého, alebo 1,33. Moly oxidu medi premeníte na gramy pomocou svojej molárnej hmotnosti nasledovne: 1,33 mol CuO x (79,55 g CuO / 1 mol CuO) = 105,80 g CuO.
Vykonajte svoju reakciu a zvážte svoj produkt na elektronickej váhe, potom pomocou tejto hodnoty vypočítajte percentuálny výnos. Napríklad, ak sa vašich 250,04 gramov dusičnanu meďnatého rozložilo na 63,41 gramov oxidu medi, keď zahriaty, váš percentuálny výťažok bol 63,41 g CuO / 105,80 g CuO - váš izolovaný výťažok nad teoretickým výťažkom - alebo 59.93%.
Referencie
- Wisc Online: Výťažok produktu v chemických reakciách
Tipy
- „Molekulovú hmotnosť“ látky môžete určiť súčtom hmotností, ktoré dáva periodická tabuľka pre každý z jej atómov. Napríklad na výpočet hmotnosti Cu (NO3) 2 zvážte, že táto zlúčenina obsahuje jeden atóm medi, dva atómy dusíka a šesť atómov kyslíka. Poraďte sa vo svojej periodickej tabuľke a zistite, či má meď atómovú hmotnosť 63,55 gramu, dusík 14,01 gramu a kyslík 16,00 gramov. Sčítajte ich dohromady - 63,55 + (2 x 14,01) + (6 x 16,00) - aby ste určili, že Cu (NO3) 2 má molekulovú hmotnosť 187,57 amu.
- Majte na pamäti, že vyjadrujete "molárnu" hmotnosť - počet gramov látky jeden "mol" z látka obsahuje - použije sa rovnaké číslo ako molekulová hmotnosť, iba sa použijú gramy namiesto „atómová hmotnosť jednotky “(amu).
O autorovi
Robert Schrader je spisovateľ, fotograf, cestovateľ po svete a tvorca oceneného blogu Leave Your Daily Hell. Ak nie je na svete, nájdete ho v krásnom Austine v štáte TX, kde žije so svojou partnerkou.
Fotoúvery
Matné kadičky na obraz vodky od Galaiko Sergey z Fotolia.com