As células eletroquímicas informam sobre como as baterias carregam os circuitos e como dispositivos eletrônicos como telefones celulares e relógios digitais são alimentados. Olhando para a química das células E, o potencial das células eletroquímicas, você encontrará reações químicas que as alimentam e enviam corrente elétrica através de seus circuitos. O potencialEde uma célula pode dizer como essas reações ocorrem.
Calculando E Cell
•••Syed Hussain Ather
Pontas
Manipule as meias reações reorganizando-as, multiplicando-as por valores inteiros, invertendo o sinal do potencial eletroquímico e multiplicando o potencial. Certifique-se de seguir as regras de redução e oxidação. Some os potenciais eletroquímicos para cada meia reação em uma célula para obter o potencial eletroquímico ou eletromotriz total de uma célula.
Para calcular opotencial eletromotriz, também conhecido como potencial da força eletromotriz (EMF), de umgalvânico, ou voltaica, célula usando a fórmula da célula E ao calcular a célula E:
- Divida a equação em meias reações, se ainda não estiver.
- Determine quais equações, se houver, devem ser invertidas ou multiplicadas por um inteiro. Você pode determinar isso primeiro descobrindo quais meias reações são mais prováveis de ocorrer em uma reação espontânea. Quanto menor a magnitude do potencial eletroquímico para uma reação, mais provável é que ela ocorra. No entanto, o potencial de reação geral deve permanecer positivo.
- Por exemplo, uma meia reação com potencial eletroquímico de-.5 Vé mais provável de ocorrer do que um com potencial1 V.
- Quando você determinar quais reações são mais prováveis de ocorrer, elas formarão a base da oxidação e redução usadas na reação eletroquímica.
- Inverta as equações e multiplique ambos os lados das equações por números inteiros até que eles totalizem a reação eletroquímica geral e os elementos em ambos os lados se cancelem. Para qualquer equação que você lançar, inverta o sinal. Para qualquer equação que você multiplique por um inteiro, multiplique o potencial pelo mesmo inteiro.
- Resuma os potenciais eletroquímicos para cada reação, levando em consideração os sinais negativos.
Você pode se lembrar do ânodo cátodo da equação da célula E com o mnemônico "Gato vermelho e boi" que informavermelhoação ocorre nogatoHode e oatributoboiidizes.
Calcule os potenciais de eletrodo das seguintes meias-células
Por exemplo, podemos ter uma célula galvânica com uma fonte de energia elétrica DC. Ele usa as seguintes equações em uma bateria alcalina AA clássica com potenciais eletroquímicos de meia reação correspondentes. Calcular o e-cell é fácil usando oEequação da célula para o cátodo e ânodo.
- MnO2(s) + H2O + e− → MnOOH (s) + OH-(aq); Eo= +0,382 V
- Zn (s) + 2 OH -(aq) → Zn (OH)2(s) + 2e-; Eo = +1,221 V
Neste exemplo, a primeira equação descreve a águaH2Osendo reduzido pela perda de um próton (H+) formarOH- enquanto óxido de magnésioMnO2é oxidado ao ganhar um próton (H+) para formar óxido-hidróxido de manganêsMnOOH.A segunda equação descreve o zincoZntornando-se oxidado com dois íons hidróxidoOH - para formar hidróxido de zinco Zn (OH)2 enquanto libera dois elétrons.
Para formar a equação eletroquímica geral que desejamos, primeiro observe que a equação (1) é mais provável de ocorrer do que a equação (2) porque tem uma magnitude menor de potencial eletroquímico. Esta equação é uma redução de águaH2Opara formar hidróxidoOH-e oxidação de óxido de magnésioMnO2. Isso significa que o processo correspondente da segunda equação deve oxidar hidróxidoOH-para reverter para a águaH2O.Para conseguir isso, você deve reduzir o hidróxido de zincoZn (OH)2de volta ao zincoZn.
Isso significa que a segunda equação deve ser invertida. Se você virar e mudar o sinal do potencial eletroquímico, você obtémZn (OH)2(s) + 2e- → Zn (s) + 2 OH -(aq) com um potencial eletroquímico correspondenteEo = -1,221 V.
Antes de somar as duas equações, você deve multiplicar cada reagente e produto da primeira equação por o inteiro 2 para garantir que os 2 elétrons da segunda reação equilibrem o único elétron da primeira 1. Isso significa que nossa primeira equação se torna 2MnO2(s) + 2 H2O + 2e− → 2MnOOH (s) + 2OH-(aq)com um potencial eletroquímico deEo= +0,764 V
Adicione essas duas equações e os dois potenciais eletroquímicos juntos para obter uma reação combinada: 2MnO2(s) + 2 H2O + Zn (OH)2(s) → Zn (s) + MnOOH (s)com potencial eletroquímico-0,457 V. Observe que os 2 íons hidróxido e os 2 elétrons em ambos os lados se cancelam ao criar a fórmula ECell.
Química de células E
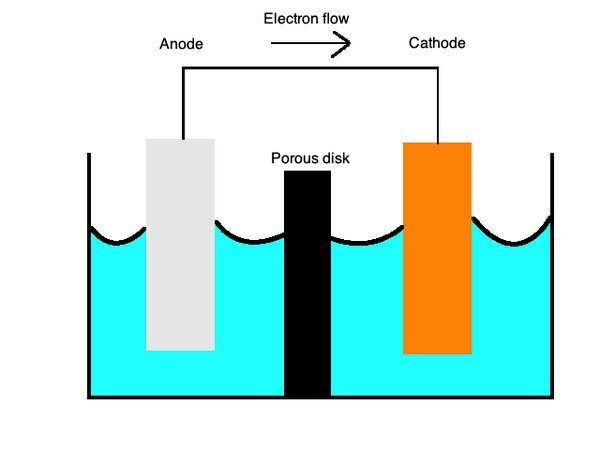
Essas equações descrevem os processos de oxidação e redução com uma membrana semiporosa separada por uma ponte de sal. OPonte de salé feito de um material como o sulfato de potássio, que funciona como um eletrólito inerte que permite que o íon se difunda em sua superfície.
Nocátodos, ocorre a oxidação ou perda de elétrons e, noânodos, ocorre redução ou ganho de elétrons. Você pode se lembrar disso com a palavra mnemônica "OILRIG". Ele informa que "Oxidation Is Loss" ("OIL") e "Reduction Is Gain" ("RIG"). O eletrólito é o líquido que permite que os íons fluam por essas duas partes da célula.
Lembre-se de priorizar as equações e reações que são mais prováveis de ocorrer porque têm uma magnitude menor de potencial eletroquímico. Essas reações formam a base para as células galvânicas e todos os seus usos, e reações semelhantes podem ocorrer em contextos biológicos. As membranas celulares geram potencial elétrico transmembrana conforme os íons se movem através da membrana e através dos potenciais químicos eletromotrizes.
Por exemplo, a conversão de dinucleotídeo de adenina nicotinamida reduzido (NADH) na presença de prótons (H+) e oxigênio molecular (O2) produz sua contraparte oxidada (NAD+) ao lado da água (H2O) como parte da cadeia de transporte de elétrons. Isso ocorre com um prótongradiente eletroquímicocausada pelo potencial de permitir que a fosforilação oxidativa ocorra na mitocôndria e produza energia.
Equação de Nernst
OEquação de Nernstpermite calcular o potencial eletroquímico usando as concentrações de produtos e reagentes em equilíbrio com o potencial da célula em voltsEcélula como
E_ {célula} = E_ {célula} ^ - \ frac {RT} {zF} \ ln {Q}
no qualE-célula é o potencial para a meia reação de redução,Ré a constante universal de gás (8,31 J x K − 1 mol − 1), Té a temperatura em Kelvins,zé o número de elétrons transferidos na reação, eQé o quociente de reação da reação geral.
O quociente de reaçãoQé uma razão envolvendo concentrações de produtos e reagentes. Para a reação hipotética:aA + bB ⇌ cC + dDcom reagentesUMAeB, produtosCeD, e valores inteiros correspondentesuma, b, c, ed, o quociente de reaçãoQseriaQ = [C]c[D]d / [UMA]uma[B]bcom cada valor entre colchetes como a concentração, geralmente emmol / L. Para qualquer exemplo, a reação mede essa proporção de produtos para reagentes.
Potencial de uma célula eletrolítica
Células eletrolíticasdiferem das células galvânicas porque usam uma fonte de bateria externa, não o potencial eletroquímico natural, para conduzir eletricidade pelo circuito. pode usar eletrodos dentro do eletrólito em uma reação não espontânea.
Essas células também usam um eletrólito aquoso ou fundido em contraste com a ponte de sal das células galvânicas. Os eletrodos correspondem ao terminal positivo, o ânodo, e ao terminal negativo, o cátodo, da bateria. Enquanto as células galvânicas têm valores de EMF positivos, as células eletrolíticas têm valores negativos, o que significa que, para células galvânicas, as reações ocorrem espontaneamente, enquanto as células eletrolíticas requerem uma voltagem externa fonte.
Semelhante às células galvânicas, você pode manipular, inverter, multiplicar e adicionar as equações de meia reação para produzir a equação geral da célula eletrolítica.
