Kinetikk er grenen av fysisk kjemi som studerer frekvensen av kjemiske reaksjoner. Derimot forteller termodynamikk oss hvilken retning av reaksjonen er favorisert uten å avsløre reaksjonshastigheten. Noen reaksjoner kan være termodynamisk favoriserte, men kinetisk ugunstige.
For eksempel, ved konvertering av diamant til grafitt, har grafitt lavere fri energi enn diamant, så konverteringen er termodynamisk favorisert. Imidlertid er det en stor aktiveringsbarriere for diamant for å bryte og reformere alle obligasjoner til mer stabil grafittkonfigurasjon, og dermed er denne reaksjonen kinetisk ugunstig og vil faktisk ikke forekomme.
Reaksjonsfrekvens
De reaksjonshastighet er et mål på hvor raskt produktene dannes og reaktantene forbrukes, slik at du kan bestemme det ved å måle endringen i konsentrasjonen av produkter eller reaktanter over en periode. Vurder en generell kjemisk reaksjon:
aA + bB> cC + dD
Reaksjonshastigheten kan skrives som:
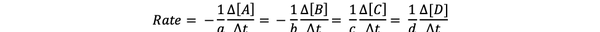
•••Modifisert fra https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
For eksempel reaksjonshastigheten for:
2 NO (g) + 2 H2 (g)> N2(g) + 2 H2O (g)
er gitt av
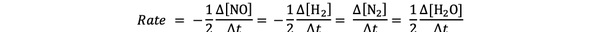
•••Tilpasset fra https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
For å bestemme hastigheten på denne reaksjonen ved eksperiment, kan du måle konsentrasjonen av H2 på forskjellige tidspunkter av reaksjonen, og plotte den mot tiden som følger:
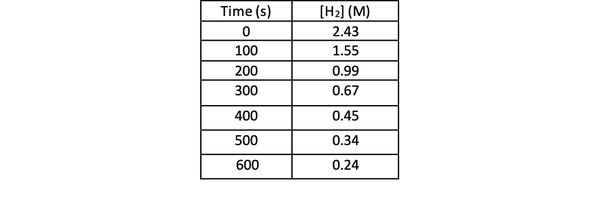
•••Modifisert fra https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
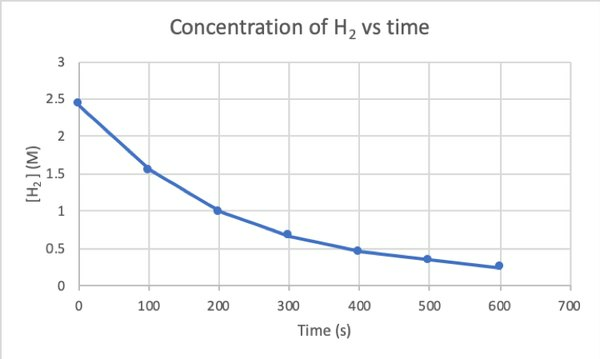
•••Modifisert fra https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
De gjennomsnittlig reaksjonshastighet er en tilnærming til reaksjonshastigheten i et tidsintervall og kan betegnes med:
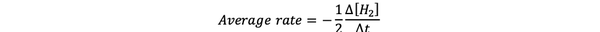
•••Modifisert fra https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
De øyeblikkelig reaksjonshastighet er definert som reaksjonshastigheten på et tidspunkt. Det er en differensialrate og kan uttrykkes av:
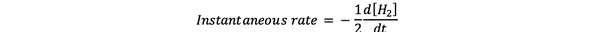
•••Modifisert fra https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
Hvor d [H2] / dt er hellingen for konsentrasjonskurven til H2 mot tid på tid t.
De innledende reaksjonshastighet er den øyeblikkelige hastigheten ved reaksjonsstart, når t = 0. I dette tilfellet enhet for gjennomsnittlig, øyeblikkelig og initial reaksjonshastighet er M / s.
Vurder lov
I de fleste tilfeller er reaksjonshastigheten avhengig av konsentrasjonen av de forskjellige reaktantene på tidspunktet t. For eksempel, i en høyere konsentrasjon av alle reaktanter, reagerer reaktantene oftere og resulterer i en raskere reaksjon. Forholdet mellom reaksjonshastighet ν (t) og konsentrasjonene er definert som takstlov. Og hastighetsloven for den generelle kjemiske reaksjonen aA + bB> cC + dD er:
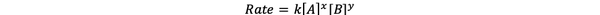
•••Modifisert fra https://chem.libretexts.org/Bookshelves/Ancillary_Materials/Laboratory_Experiments/Wet_Lab_Experiments/General_Chemistry_Labs/Online_Chemistry_Lab_Manual/Chem_12_Experiments/01%3A_Chemical_Kinetics_-_The_Method_of_Initial_Rates_(Experiment)
Der k er hastighetskonstant, og kraften x og y er rekkefølge av reaksjonen med hensyn til reaktant A og B. Hastighetsloven må bestemmes eksperimentelt og kan ikke utledes fra bare støkiometrien til en balansert kjemisk reaksjon.
Metode for innledende priser
Satsloven kan bestemmes av metode for innledende satser. I denne metoden utføres eksperimentet flere ganger, bare endrer konsentrasjonen av en reaktant for hvert løp mens andre variabler holdes konstant. Reaksjonshastigheten måles for hvert løp for å bestemme rekkefølgen for hver reaktant i hastighetsloven.
Tenk for eksempel på følgende startdata for reaksjonen:
2 NO (g) + 2 H2 (g)> N2(g) + 2 H2O (g)
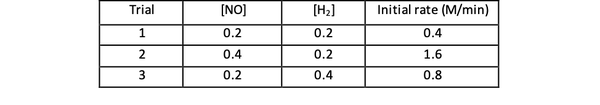
•••Tilpasset fra https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
For prøve 1 og 3 holdes konsentrasjonen av NO konstant mens konsentrasjonen av H.2 er doblet. Som et resultat doblet den opprinnelige reaksjonshastigheten også (tenk på den som 21), slik at du kan konkludere med y = 1. For prøve 1 og 2 dobles konsentrasjonen av NO mens konsentrasjonen av H.2 forblir konstant. Resultatet av denne endringen er at den opprinnelige renten ble firedoblet (tenk på den som 22). Du kan derfor konkludere med x = 2.
Takstloven for denne reaksjonen er derfor:
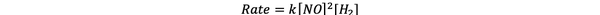
•••Tilpasset fra https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
Og reaksjonen er det første orden i H2 og andre bestilling i NO.
