Koolstof is een niet-metalen element met een chemisch symbool van C. Het is het vierde meest voorkomende element in het universum en het 15e meest voorkomende element in de aardkorst. Het is ook het tweede meest voorkomende element in de mens na zuurstof. De chemische samenstelling ervan leidt tot verschillende unieke eigenschappen van koolstof.
Koolstof behoort tot groep 14 van het periodiek systeem. Het atoomnummer is 6 en het heeft een atoomgewicht van 12.011. De oxidatietoestanden van koolstof kunnen variëren van -4 tot +4, waarbij +4 voorkomt in verbindingen zoals methaan en koolstofdisulfide, en +2 voor koolmonoxide.
De fysieke eigenschappen van verschillende koolstofallotropen maken ze bruikbaar in batterijen, elektronica en nanomaterialen. Koolstof is ook de 'koning der elementen', die zich bijna vormt 10 miljoen verbindingen tot op heden met inbegrip van organische, anorganische en organometaalverbindingen.
Isotopen van koolstof worden veelvuldig gebruikt voor radiokoolstofdatering (koolstof-14), moleculaire structuur en medisch onderzoek (koolstof-13). Bovendien vertonen koolstofvezels uitstekende mechanische eigenschappen en zijn ze populair in de ruimtevaart en civiele techniek.
Allotropen van koolstof
Koolstof heeft verschillende allotrope vormen, met diverse moleculaire configuraties en atomaire structuren. De fysieke eigenschappen van koolstof variëren sterk met elke allotroop. Enkele van de meest bekende allotropen van koolstof zijn grafiet, diamant en fullerenen.
Grafiet is een van de zachtste bekende materialen en wordt gebruikt in potloden en als vast smeermiddel. Het is ook een goede geleider van elektriciteit, waardoor het bruikbaar is in batterijen en zonnepanelen.
Grafeen is gewoon een atomaire laag grafiet gerangschikt in een honingraatrooster. In een grafeenlaag is elk koolstofatoom covalent gebonden aan drie andere atomen, waardoor het vierde elektron vrij blijft om in het vlak te migreren, vandaar de elektrische geleidbaarheid.
Diamant daarentegen is de hardste van nature voorkomende stof en is een van de unieke eigenschappen van koolstof. Het heeft bijna twee keer de dichtheid van grafiet en elk koolstofatoom is tetraëdrisch gebonden aan vier andere zonder vrij stromende elektronen. Zo is diamant een slechte geleider van elektriciteit. Diamant ziet er ook helder uit, in tegenstelling tot grafiet, dat ondoorzichtig is.
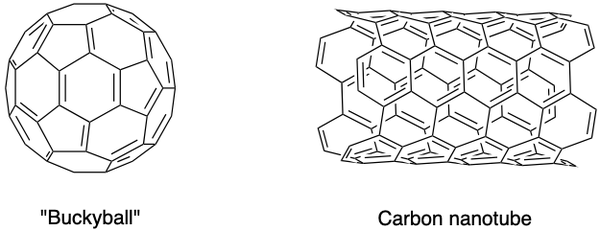
Wetenschappers hebben ook andere allotropen van koolstof gesynthetiseerd, zoals fullerenen, koolstofnanoschuim en andere. Ze bezitten bijzondere eigenschappen en vormen een bloeiend onderzoeksgebied op het gebied van nanomaterialen. Fullerenen zijn een groep holle koolstofmoleculen in een gesloten kooi (buckyball) of cilinder (koolstof nanobuisjes) conformatie.
•••Gemaakt met ChemDraw
de C60 buckyball werd ontdekt door Sir Harold Kroto, Richard Smalley en Robert Curl Jr., met behulp van een laser om grafietstaven in een heliumatmosfeer te verdampen. De koolstofatomen zijn met elkaar verbonden door enkele en dubbele bindingen om 12 vijfhoekige en 20 zeshoekige vlakken in de vorm van een voetbal te vormen. Hun baanbrekende inspanningen leverden hen in 1996 de Nobelprijs op.
Koolstofnanobuisjes, die langwerpige versies van buckyballs zijn, werden geïdentificeerd door Iijima Sumio. Ze zijn uitstekende geleiders van warmte en elektriciteit en zijn nuttig voor elektronica.
Koolstofnanobuisjes vertonen ook een indrukwekkende treksterkte en hebben opwindende toepassingen in structurele materialen en medicijnen. De gecontroleerde synthese van dergelijke nanomaterialen vormt echter een grote uitdaging voor wetenschappers.
Chemische reactiviteit van koolstof
Koolstof vormt de basis van het leven op aarde, met miljoenen koolstofhoudende verbindingen die 18 procent van alle levende wezens uitmaken. Het kan stabiele, covalente bindingen vormen met andere atomen en verschijnen als lange ketens of ringen van sterke onderling verbonden koolstof-koolstofbindingen. Deze dragen bij aan de diversiteit en complexiteit van koolstofverbindingen die op aarde bestaan.
Deze koolstofverbindingen omvatten organische moleculen zoals eiwitten, koolhydraten en DNA die in de cellen van levende organismen worden aangetroffen, evenals anorganische verbindingen zoals koolstofoxiden. De studie van organische moleculen vormt een gespecialiseerd gebied dat organische chemie wordt genoemd. Koolstof kan ook covalente bindingen vormen met metaal als organometaalverbindingen. IJzerporfyrine, de zuurstofbindingsplaats van hemoglobine, is zo'n voorbeeld.
Ondanks zijn overvloed in de natuur, is koolstof onder normale omstandigheden relatief onreactief. Bij standaardtemperatuur is het niet reactief ten opzichte van zuren (zwavelzuur of zoutzuur) of alkaliën. Het is ook stabiel tegen oxidatie bij deze temperatuur. Bij hogere temperaturen kan koolstof echter reageren met zuurstof tot koolstofoxiden (CO2 en CO), met zwavelgas om koolstofdisulfide te vormen en met silicium om carbiden te vormen.
Isotopen van koolstof
Er zijn 15 bekende isotopen van koolstof, waarvan koolstof-12 (98,93 procent van natuurlijke koolstof) en koolstof-13 (1,07 procent) de twee stabiele isotopen zijn. Koolstof-14 is de langstlevende isotoop, met een halfwaardetijd van 5.730 jaar. De kortstlevende koolstofisotoop is koolstof-8 en heeft een halfwaardetijd van 1,98739 x 10−21 seconden.
De isotoop koolstof-14 wordt weergegeven door 146C, waarbij het presuperscript 14 de atoommassa is en het presubscript 6 het atoomnummer. Koolstof-14 heeft een zeer lage natuurlijke abundantie (0,0000000001 procent), maar door de lange halfwaardetijd is het nuttig voor: radiometrische datering.
Koolstof-14 wordt gevormd wanneer stikstof-14 reageert met neutronen van kosmische straling, waarbij daarbij een proton vrijkomt. De koolstof-14 reageert vervolgens met zuurstof om te genereren 14CO2, die gelijkmatig in de atmosfeer wordt verdeeld met 12CO2.
147N + 10n > 146C + 11p
De koolstofcyclus begint wanneer levende organismen koolstofdioxide omzetten (14CO2 en 12CO2 uit de atmosfeer) in organische verbindingen door fotosynthese en geven het terug aan de atmosfeer door ademhaling. In dit evenwicht is er een vaste verhouding van 14CO2 en 12CO2 in de organismen. Wanneer ze echter afsterven, stopt het evenwicht en ondergaat koolstof-14 bètaverval tot stikstof-14 volgens zijn halfwaardetijd van 5.730 jaar.
146C > 147N + 0-1e
Meting van het relatieve aandeel van koolstof-14 in een dood monster maakt het dus mogelijk de tijd te berekenen die is verstreken na zijn dood. Deze methode van koolstofdatering is op grote schaal gebruikt voor het dateren van fossielen en archeologische exemplaren van 500 tot 50.000 jaar oud.
Koolstof-13 is een andere isotoop die op grote schaal in veel toepassingen wordt gebruikt. Het wordt bijvoorbeeld gebruikt in nucleaire magnetische resonantie (NMR) voor het bepalen van moleculaire structuren van organische verbindingen. Het wordt ook gebruikt als etiketteermiddel in combinatie met een massaspectrometer voor medisch onderzoek.
Mechanische eigenschappen van koolstofvezels
Koolstof vertoont ook nuttige mechanische eigenschappen, behalve de fysische, chemische en nucleaire eigenschappen.
Het kan vormen legeringen met staal tot koolstofstaal, waarvan het koolstofgehalte varieert van 0,05 tot 2 gewichtsprocent. Medium-koolstofstaal (0,3-0,6 procent koolstof) heeft een uitgebalanceerde sterkte en vervormbaarheid, evenals een uitstekende treksterkte. Door een proces van warmtebehandeling kan staal met een ultrahoog koolstofgehalte (1,25-2 procent koolstof) tot grote hardheid worden getemperd en worden gebruikt voor de vervaardiging van messen.
Koolstofvezels, die 5 tot 10 μm dikke vezels zijn die voornamelijk uit koolstofatomen bestaan, vertonen een hoge stijfheid, treksterkte, chemische weerstand, temperatuurtolerantie en laag gewicht en thermisch uitbreiding. De vloeigrens van staal is afhankelijk van de kwaliteit en zacht staal heeft een vloeigrens van 247 MPa. Koolstofvezels hebben treksterktes variërend van 1.600 tot 6.370 MPa en zijn daarom populair op het gebied van lucht- en ruimtevaart, civiele techniek en sport.
Wanneer er een spanning op een materiaal wordt uitgeoefend, vervormt het eerst elastisch. In dit stadium kan het terugkeren naar zijn oorspronkelijke vorm wanneer de spanning wordt verwijderd. Opbrengststerkte wordt gedefinieerd als de spanning die een materiaal kan weerstaan zonder blijvende vervorming.
Wanneer het een punt bereikt (bovenste vloeigrens) waar het niet langer kan terugkeren naar zijn oorspronkelijke afmetingen, ondergaat het een plastische vervorming, die permanent en onomkeerbaar is. Treksterkte is de maximale sterkte die een materiaal kan weerstaan zonder te falen of te breken.
