バッテリーが消耗するのに遭遇したことがあるかもしれません。これは、電子機器でバッテリーを使用しようとしている場合は厄介です。 電池の電池の化学的性質は、電池がどのように平らになるかなど、電池がどのように機能するかの特性を教えてくれます。
電池の細胞化学
•••サイードフセインアザー
電池の電気化学反応によって材料が消耗すると、電池は消耗します。 これは通常、長時間のバッテリー使用後に発生します。
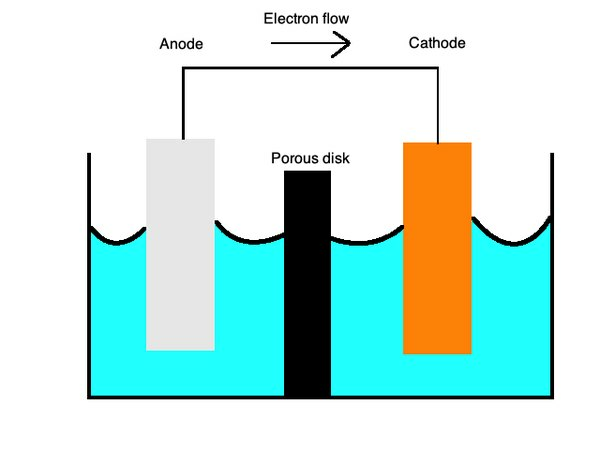
バッテリーは一般的に一次電池を使用します。ガルバニ電池これは、液体電解質に2つの異なる金属を使用して、それらの間で電荷を移動できるようにします。 から正電荷が流れます陰極、陽イオンまたは銅などの正に帯電したイオンで構築され、アノード、陰イオンまたは亜鉛などの負に帯電したイオンを使用します。
チップ
電解液の化学物質がバッテリー内で乾く結果、バッテリーは平らになります。 アルカリ乾電池の場合、二酸化マンガンがすべて変換されたときです。 この段階では、バッテリーは消耗しています。
この関係を思い出すために、「OILRIG」という言葉を思い出すことができます。 これはあなたにそれを伝えます酸化は損失です(「オイル」)および削減は利益です(「RIG」)の電子。 ザ・アノードとカソードのニーモニックsは「ANOXREDCAT」であり、「ANode」は「OXidation」とともに使用され、「REDuction」は「CAThode」で発生することを覚えておいてください。
一次電池は、塩橋または多孔質膜で接続されたイオン溶液中のさまざまな金属の個々の半電池でも機能します。 これらのセルは、バッテリーに無数の用途を提供します。
アルカリ乾電池亜鉛アノードとマグネシウムカソード間の反応を具体的に使用する、は、懐中電灯、携帯用電子機器、およびリモコンに使用されます。 一般的な電池要素の他の例には、リチウム、水銀、シリコン、酸化銀、クロム酸、および炭素が含まれます。
エンジニアリング設計では、バッテリーが平らになる方法を利用して、エネルギーを節約して再利用できます。 低コストの家庭用バッテリーは、一般に、亜鉛がガルバニック腐食、金属が優先的に腐食するプロセスでは、バッテリーは閉じた電子回路の一部として電気を生成する可能性があります。
バッテリーはどの温度で爆発しますか? リチウムイオン電池のセルケミストリーは、これらの電池が化学反応を開始し、約1,000°Cで爆発することを意味します。 それらの内部の銅材料が溶けて、内部のコアが破損します。
化学セルの歴史
1836年に英国の化学者ジョンフレデリックダニエルはダニエル電池彼は1つではなく2つの電解質を使用して、一方が生成した水素をもう一方が消費できるようにしました。 彼は、当時のバッテリーの一般的な慣習である硫酸の代わりに硫酸亜鉛を使用していました。
それ以前は、科学者たちは自発反応を利用する化学セルの一種であるボルタ電池を使用していましたが、これは急速に電力を失いました。 ダニエルは、銅板と亜鉛板の間にバリアを使用して、過剰な水素が泡立つのを防ぎ、バッテリーがすぐに消耗するのを防ぎました。 彼の仕事は、電気エネルギーを使用して金属を製造する方法である電信と電気冶金の革新につながるでしょう。
充電式電池が平らになる方法
二次電池一方、充電式です。 蓄電池、二次電池、または蓄電池とも呼ばれる充電式電池は、カソードとアノードが互いに回路で接続されているため、時間の経過とともに電荷を蓄積します。
充電すると、酸化ニッケル水酸化物などの正の活性金属が酸化され、電子が生成されます カドミウムなどのネガティブな物質が減少し、電子を捕獲して獲得する一方で、それらを失います それら。 バッテリーは、外部電圧源として交流電気を含むさまざまなソースを使用して、充電-放電サイクルを使用します。
充電式電池は、反応に関与する材料が充電および再充電する能力を失うため、繰り返し使用した後でも平らになる可能性があります。 これらのバッテリーシステムが消耗すると、バッテリーが消耗するさまざまな方法があります。
バッテリーは日常的に使用されているため、鉛蓄電池などの一部のバッテリーは充電できなくなる可能性があります。 リチウムイオン電池のリチウムは、充放電サイクルに再び入ることができない反応性リチウム金属になる可能性があります。 液体電解質を使用したバッテリーは、蒸発や過充電により水分が減少する場合があります。
二次電池の応用
これらのバッテリーは、一般的に自動車のスターター、車椅子、電動自転車、電動工具、バッテリー貯蔵発電所で使用されています。 科学者とエンジニアは、ハイブリッド内燃バッテリーと電気自動車での使用を研究して、電力使用でより効果的になり、長持ちするようになりました。
充電式鉛蓄電池は水分子を破壊します(H2O)水素水溶液に(H+)および酸化物イオン(O2-)水が電荷を失うと、壊れた結合から電気エネルギーを生成します。 水素水溶液がこれらの酸化物イオンと反応すると、強いO-H結合がバッテリーに電力を供給するために使用されます。
バッテリー反応の物理学
この化学エネルギーは、高エネルギーの反応物を低エネルギーの生成物に変換する酸化還元反応を促進します。 反応物と生成物の違いにより、化学エネルギーを電気エネルギーに変換してバッテリーを接続すると、反応が起こり、電気回路が形成されます。
ガルバニ電池では、金属亜鉛などの反応物は自由エネルギーが高く、外力なしで自然に反応を起こすことができます。
アノードとカソードで使用される金属は、化学反応を促進することができる格子凝集エネルギーを持っています。 格子凝集エネルギーは、金属を互いに作る原子を分離するために必要なエネルギーです。 金属亜鉛、カドミウム、リチウム、ナトリウムは、元素から電子を除去するために必要な最小エネルギーである高いイオン化エネルギーを持っているため、よく使用されます。
同じ金属のイオンによって駆動されるガルバニ電池は、自由エネルギーの違いを利用して、ギブズの自由エネルギーに反応を駆動させることができます。 ザ・ギブズの自由エネルギーは、熱力学的プロセスが使用する仕事量を計算するために使用される別の形式のエネルギーです。
この場合、標準ギブズの自由エネルギーの変化Go 電圧、または起電力を駆動しますEo方程式によると、ボルトで
E ^ {\ text {o}} = \ frac {-\ Delta_rG ^ {\ text {o}}} {v_eF}
その中でveは反応中に移動した電子の数であり、Fはファラデー定数です(F = 96485.33 C mol−1).
ザ・ΔrGo 方程式がギブズの自由エネルギーの変化を使用することを示します(ΔrGo =G最後の - G初期).反応が利用可能な自由エネルギーを使用するにつれて、エントロピーは増加します。 ダニエル電池では、亜鉛と銅の間の格子凝集エネルギーの差が、反応が発生するときのギブズの自由エネルギーの差の大部分を占めています。ΔrGo= -213 kJ / mol。これは、生成物と反応物のギブズの自由エネルギーの差です。
ガルバニ電池の電圧
ガルバニ電池の電気化学反応を酸化と還元の半反応に分離すると プロセスでは、対応する起電力を合計して、で使用される合計電圧差を取得できます。 細胞。
たとえば、典型的なガルバニ電池はCuSOを使用する場合があります4 およびZnSO4 標準電位半反応式は次のとおりです。Cu2+ + 2 e− ⇌Cu対応する起電力ポテンシャルを持つEo = +0.34 Vそして亜鉛2+ + 2 e− ⇌Zn可能性を秘めていますEo = −0.76V。
全体的な反応については、Cu2+ +Zn⇌Cu+ Zn2+ 、起電力の符号を反転させながら、亜鉛の半反応式を「反転」させて、Zn⇌Zn2+ + 2 e− とEo = 0.76V。起電力の合計である全体的な反応電位は、次のようになります。+0.34 V −(− 0.76 V)= 1.10 V.
