電気化学セルは、バッテリーが回路を充電する方法と、携帯電話やデジタル時計などの電子機器に電力を供給する方法について説明します。 電気化学セルの可能性であるEセルの化学的性質を調べると、回路に電流を送る化学反応がEセルに電力を供給していることがわかります。 可能性E細胞のは、これらの反応がどのように発生するかを教えてくれます。
Eセルの計算
•••サイードフセインアザー
チップ
半反応式を再配置し、整数値で乗算し、電気化学ポテンシャルの符号を反転し、ポテンシャルを乗算することにより、半反応式を操作します。 還元と酸化のルールに必ず従ってください。 セル内の各半反応の電気化学ポテンシャルを合計して、セルの電気化学ポテンシャルまたは起電力ポテンシャルの合計を求めます。
を計算するには起電力ポテンシャル、起電力のポテンシャルとしても知られています(EMF)、のガルバニック、またはボルタ電池、Eセルを計算するときにEセル式を使用:
- まだ行っていない場合は、方程式を半反応式に分割します。
- 反転または整数を掛ける必要がある方程式がある場合は、それを決定します。 これは、自発反応で発生する可能性が最も高い半反応を最初に把握することで判断できます。 反応の電気化学ポテンシャルの大きさが小さいほど、それが発生する可能性が高くなります。 ただし、全体的な反応電位は正のままでなければなりません。
- たとえば、電気化学ポテンシャルが-.5 V可能性のあるものよりも発生する可能性が高い1V。
- どの反応が発生する可能性が最も高いかを判断すると、それらは電気化学反応で使用される酸化と還元の基礎を形成します。
- 方程式を反転し、方程式の両側に整数を掛けて、合計が電気化学反応全体になり、両側の要素が相殺されるようにします。 反転する方程式については、符号を逆にします。 整数を掛ける方程式については、ポテンシャルに同じ整数を掛けます。
- 負の符号を考慮しながら、各反応の電気化学ポテンシャルを合計します。
あなたはあなたに告げるニーモニック「RedCatAnOx」でEセル方程式カソードアノードを思い出すことができます赤オークションはで発生しますネコhodeとAN頌歌牛idize。
次の半電池の電極電位を計算します
たとえば、DC電源を備えたガルバニ電池があるとします。 これは、対応する半反応電気化学ポテンシャルを持つ古典的な単三アルカリ電池で次の方程式を使用します。 eセルの計算は、Eカソードとアノードのセル方程式。
- MnO2(s)+ H2O + e− →MnOOH(s)+ OH-(aq); Eo= +0.382 V
- Zn(s)+ 2 OH -(aq) → 亜鉛(OH)2(s)+ 2e-; Eo = +1.221 V
この例では、最初の方程式は水を表しますH2O陽子を失うことによって減少している(H+) 申込用紙へああ- 一方、酸化マグネシウムMnO2プロトンを得ることによって酸化されます(H+)酸化マンガン-水酸化物を形成するMnOOH。2番目の方程式は亜鉛を表します亜鉛2つの水酸化物イオンで酸化されるああ - 水酸化亜鉛を形成するZn(OH)2 2つの電子を放出しながら.
必要な全体的な電気化学方程式を作成するには、電気化学ポテンシャルの大きさが小さいため、方程式(1)が方程式(2)よりも発生する可能性が高いことに最初に注意してください。 この方程式は水の還元ですH2O水酸化物を形成するああ-酸化マグネシウムの酸化MnO2. これは、2番目の方程式の対応するプロセスが水酸化物を酸化する必要があることを意味しますああ-それを水に戻すためにH2O。これを達成するには、水酸化亜鉛を減らす必要があります亜鉛(OH)2亜鉛に戻る亜鉛.
これは、2番目の方程式を反転する必要があることを意味します。 それを裏返して電気化学ポテンシャルの符号を変えると、次のようになります。亜鉛(OH)2(s)+ 2e- → Zn(s)+ 2 OH -(aq) 対応する電気化学ポテンシャルを持つEo = -1.221V。
2つの方程式を合計する前に、最初の方程式の各反応物と生成物に次の値を掛ける必要があります。 2番目の反応の2つの電子が最初の反応からの単一の電子のバランスをとることを確認する整数2 1。 これは、最初の方程式が2になることを意味しますMnO2(s)+ 2 H2O + 2e− →2MnOOH(s)+ 2OH-(aq)電気化学ポテンシャルがEo= +0.764 V
これらの2つの方程式を足し合わせ、2つの電気化学ポテンシャルを足し合わせて、組み合わせた反応を取得します。2MnO2(s)+ 2 H2O + 亜鉛(OH)2(s) → Zn(s)+ MnOOH(s)電気化学ポテンシャル-0.457 V. ECell式を作成するとき、両側の2つの水酸化物イオンと2つの電子が相殺されることに注意してください。
Eセルケミストリー
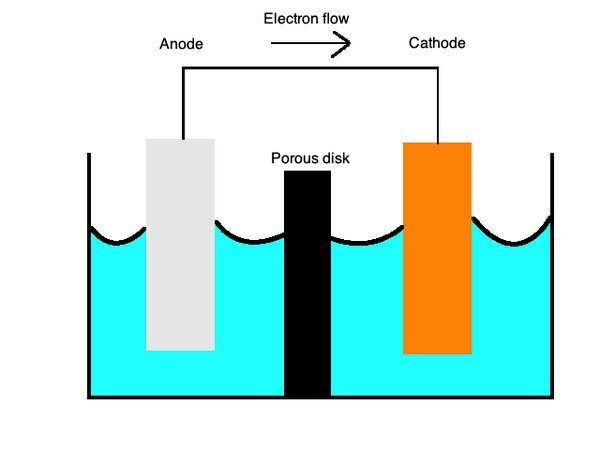
これらの方程式は、塩橋で分離された半多孔質膜を使用した酸化および還元プロセスを表しています。 ザ・塩橋硫酸カリウムなどの材料でできており、イオンを表面全体に拡散させる不活性電解質として機能します。
でカソード、酸化、または電子の損失が発生し、そして、アノード、電子の還元または獲得が発生します。 これは、ニーモニックワード「OILRIG」で思い出すことができます。 「酸化は損失」(「OIL」)と「還元は利益」(「RIG」)であることがわかります。 電解質は、イオンがセルのこれらの部分の両方を流れるようにする液体です。
電気化学ポテンシャルの大きさが小さいために発生する可能性が高い方程式と反応を優先することを忘れないでください。 これらの反応は、ガルバニ電池とそのすべての用途の基礎を形成し、同様の反応が生物学的状況で発生する可能性があります。 細胞膜は、イオンが膜を横切って起電力化学ポテンシャルを介して移動するときに膜貫通電位を生成します。
たとえば、還元型ニコチンアミドアデニンジヌクレオチドの変換(NADH)陽子の存在下で(H+)および分子状酸素(O2)その酸化された対応物を生成します(NAD+)水と一緒に(H2O)電子伝達系の一部として。 これは陽子で起こります電気化学的勾配ミトコンドリアで酸化的リン酸化を引き起こし、エネルギーを生成する可能性によって引き起こされます。
ネルンストの式
ザ・ネルンストの式ボルト単位のセル電位と平衡状態にある生成物と反応物の濃度を使用して、電気化学ポテンシャルを計算できます。E細胞 なので
E_ {cell} = E_ {cell} ^-\ frac {RT} {zF} \ ln {Q}
その中でE-細胞 還元半反応の可能性です、Rは普遍的な気体定数です(8.31 J x K-1 mol-1), Tケルビン単位の温度です。zは反応で移動した電子の数であり、Qは、反応全体の反応商です。
反応商Q生成物と反応物の濃度を含む比率です。 架空の反応の場合:aA +bB⇌cC+ dD反応物とAそしてB、製品CそしてD、および対応する整数値a, b, c、およびd、反応商QだろうQ = [C]c[D]d / [A]a[B]b括弧で囲まれた各値を濃度として、通常はmol / L. どのような例でも、反応は反応物に対する生成物のこの比率を測定します。
電解槽の可能性
電解セルガルバニ電池とは異なり、回路を介して電気を駆動するために、自然の電気化学ポテンシャルではなく、外部バッテリーソースを使用します。 非自発的な反応で電解質内の電極を使用することができます。
これらのセルは、ガルバニ電池の塩橋とは対照的に、水性または溶融電解質も使用します。 電極は、バッテリーの正端子(アノード)と負端子(カソード)に一致します。 ガルバニ電池のEMF値は正ですが、電解槽のEMF値は負です。つまり、 ガルバニ電池、電解セルが外部電圧を必要とする間、反応は自発的に起こります ソース。
ガルバニ電池と同様に、半反応式を操作、反転、乗算、および追加して、全体的な電解槽の式を作成できます。
