Kinetika adalah cabang kimia fisika yang mempelajari laju reaksi kimia. Sebaliknya, termodinamika memberi tahu kita arah reaksi mana yang disukai, tanpa mengungkapkan laju reaksinya. Beberapa reaksi dapat disukai secara termodinamika tetapi tidak disukai secara kinetik.
Misalnya, dalam konversi intan menjadi grafit, grafit memiliki energi bebas yang lebih rendah daripada intan, sehingga konversi lebih disukai secara termodinamika. Namun, ada penghalang aktivasi besar bagi berlian untuk memutuskan dan mereformasi semua ikatan menjadi lebih konfigurasi grafit stabil, sehingga reaksi ini secara kinetik tidak menguntungkan dan tidak akan benar-benar terjadi.
Tingkat Reaksi Re
Itu laju reaksi adalah ukuran seberapa cepat produk terbentuk dan reaktan dikonsumsi, sehingga Anda dapat menentukannya dengan mengukur perubahan konsentrasi produk atau reaktan, selama periode waktu tertentu. Pertimbangkan reaksi kimia umum:
aA + bB > cC + dD
Laju reaksi dapat ditulis sebagai:
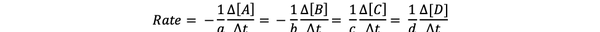
•••Dimodifikasi dari https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
Misalnya laju reaksi untuk:
2 TIDAK(g) + 2 H2 (g) > N2(g) + 2 H2O(g)
diberikan oleh
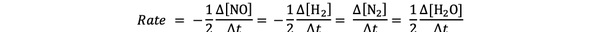
•••Diadaptasi dari https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
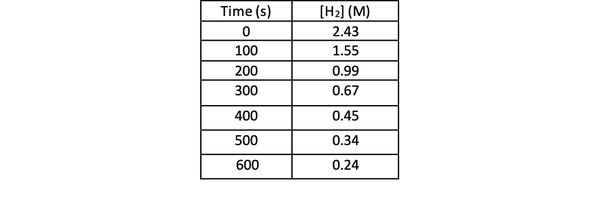
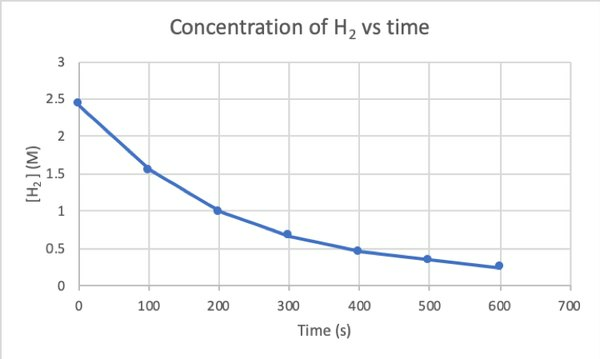
Untuk menentukan laju reaksi ini dengan percobaan, Anda dapat mengukur konsentrasi H2 pada waktu yang berbeda dari reaksi, dan plot terhadap waktu sebagai berikut:
•••Dimodifikasi dari https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
•••Dimodifikasi dari https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
Itu laju reaksi rata-rata adalah perkiraan laju reaksi dalam selang waktu dan dapat dilambangkan dengan:
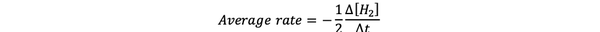
•••Dimodifikasi dari https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
Itu laju reaksi sesaat didefinisikan sebagai laju reaksi pada suatu saat tertentu. Ini adalah tingkat diferensial dan dapat dinyatakan dengan:
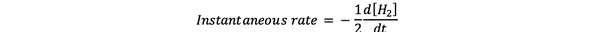
•••Dimodifikasi dari https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
Dimana d[H2]/dt adalah kemiringan kurva konsentrasi H2 versus waktu pada waktu t.
Itu laju reaksi awal adalah laju sesaat pada awal reaksi, ketika t = 0. Dalam hal ini, satuan untuk laju reaksi rata-rata, sesaat dan awal adalah M/s.
Hukum Nilai
Dalam kebanyakan kasus, laju reaksi tergantung pada konsentrasi berbagai reaktan pada waktu t. Misalnya, dalam konsentrasi yang lebih tinggi dari semua reaktan, reaktan bertabrakan lebih sering dan menghasilkan reaksi yang lebih cepat. Hubungan antara laju reaksi (t) dan konsentrasi didefinisikan sebagai hukum tarif. Dan hukum laju untuk reaksi kimia umum aA + bB > cC + dD adalah:
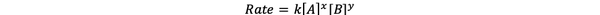
•••Dimodifikasi dari https://chem.libretexts.org/Bookshelves/Ancillary_Materials/Laboratory_Experiments/Wet_Lab_Experiments/General_Chemistry_Labs/Online_Chemistry_Lab_Manual/Chem_12_Experiments/01%3A_Chemical_Kinetics_-_The_Method_of_Initial_Rates_(Experiment)
Dimana k adalah konstanta laju, dan pangkat x dan y adalah is memesan reaksi terhadap reaktan A dan B. Hukum laju harus ditentukan secara eksperimental dan tidak dapat disimpulkan hanya dari stoikiometri reaksi kimia yang seimbang.
Metode Tarif Awal
Hukum laju dapat ditentukan dengan metode tarif awal. Dalam metode ini, percobaan dilakukan beberapa kali, hanya mengubah konsentrasi satu reaktan untuk setiap putaran sambil menjaga variabel lainnya konstan. Laju reaksi diukur untuk setiap putaran untuk menentukan orde masing-masing reaktan dalam hukum laju.
Sebagai contoh, perhatikan data laju awal berikut untuk reaksi:
2 TIDAK(g) + 2 H2 (g) > N2(g) + 2 H2O(g)
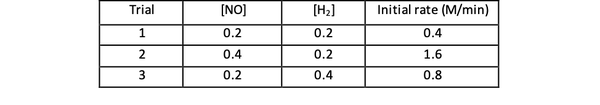
•••Diadaptasi dari https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
Untuk percobaan 1 dan 3, konsentrasi NO dijaga konstan sedangkan konsentrasi H2 digandakan. Akibatnya, laju reaksi awal juga berlipat ganda (anggap saja sebagai 21), sehingga Anda dapat menyimpulkan y = 1. Untuk percobaan 1 dan 2, konsentrasi NO digandakan sedangkan konsentrasi H2 tetap konstan. Hasil dari perubahan ini adalah bahwa tingkat awal empat kali lipat (anggap saja sebagai 22). Oleh karena itu, Anda dapat menyimpulkan x = 2.
Oleh karena itu, hukum laju untuk reaksi ini adalah:
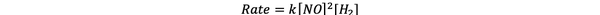
•••Diadaptasi dari https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
Dan reaksinya adalah pesanan pertama di H2 dan pesanan kedua di TIDAK.

