La cinética es la rama de la química física que estudia la velocidad de las reacciones químicas. Por el contrario, la termodinámica nos dice qué dirección de la reacción se favorece, sin revelar su velocidad de reacción. Algunas reacciones pueden favorecerse termodinámicamente pero desfavorecerse cinéticamente.
Por ejemplo, en la conversión de diamante a grafito, el grafito tiene una energía libre más baja que el diamante, por lo que la conversión se ve favorecida termodinámicamente. Sin embargo, existe una gran barrera de activación para que el diamante rompa y reforme todos los enlaces a los más configuración de grafito estable, por lo que esta reacción es cinéticamente desfavorecida y no ocurrirá realmente.
Tasa de reacción
La tasa de reacción es una medida de qué tan rápido se forman los productos y se consumen los reactivos, por lo que puede determinarlo midiendo el cambio en la concentración de productos o reactivos, durante un período de tiempo. Considere una reacción química general:
aA + bB> cC + dD
La velocidad de reacción se puede escribir como:
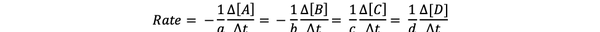
•••Modificado de https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
Por ejemplo, la velocidad de reacción para:
2 NO (g) + 2 H2 (g)> N2(g) + 2 H2O (g)
es dado por
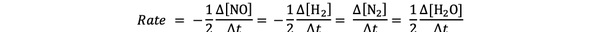
•••Adaptado de https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
Para determinar la velocidad de esta reacción mediante un experimento, puede medir la concentración de H2 en diferentes momentos de la reacción y grafíquelo contra el tiempo de la siguiente manera:
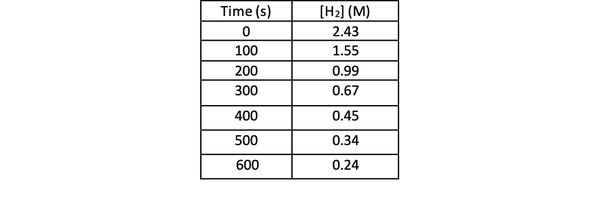
•••Modificado de https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
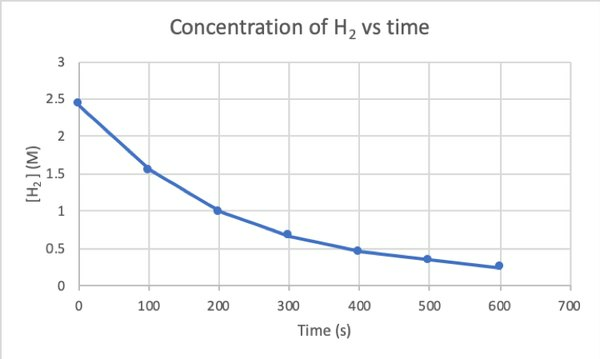
•••Modificado de https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
La velocidad media de reacción es una aproximación de la velocidad de reacción en un intervalo de tiempo y se puede denotar por:
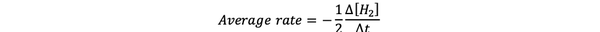
•••Modificado de https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
La velocidad instantánea de reacción se define como la velocidad de reacción en algún momento. Es una tasa diferencial y se puede expresar mediante:
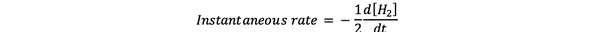
•••Modificado de https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
Donde d [H2] / dt es la pendiente de la curva de concentración de H2 versus tiempo en el tiempo t.
La velocidad inicial de reacción es la velocidad instantánea al inicio de la reacción, cuando t = 0. En este caso, el unidad para la velocidad de reacción promedio, instantánea e inicial es M / s.
Ley de tarifas
En la mayoría de los casos, la velocidad de reacción depende de la concentración de los diversos reactivos en el tiempo t. Por ejemplo, en una concentración más alta de todos los reactivos, los reactivos chocan con más frecuencia y dan como resultado una reacción más rápida. La relación entre la velocidad de reacción ν (t) y las concentraciones se define como la ley de tarifas. Y la ley de velocidad para la reacción química general aA + bB> cC + dD es:
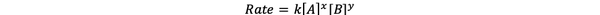
•••Modificado de https://chem.libretexts.org/Bookshelves/Ancillary_Materials/Laboratory_Experiments/Wet_Lab_Experiments/General_Chemistry_Labs/Online_Chemistry_Lab_Manual/Chem_12_Experiments/01%3A_Chemical_Kinetics_-_The_Method_of_Initial_Rates_(Experiment)
Donde k es la constante de velocidad y la potencia xey es la pedido de la reacción con respecto al reactivo A y B. La ley de velocidad debe determinarse experimentalmente y no puede deducirse solo de la estequiometría de una reacción química equilibrada.
Método de tarifas iniciales
La ley de tasas puede ser determinada por la método de tasas iniciales. En este método, el experimento se realiza varias veces, solo cambiando la concentración de un reactivo para cada ejecución mientras se mantienen constantes las otras variables. La velocidad de la reacción se mide para cada ejecución para determinar el orden de cada reactivo en la ley de velocidad.
Por ejemplo, considere los siguientes datos de velocidad inicial para la reacción:
2 NO (g) + 2 H2 (g)> N2(g) + 2 H2O (g)
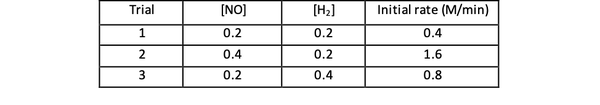
•••Adaptado de https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
Para las pruebas 1 y 3, la concentración de NO se mantiene constante mientras que la concentración de H2 se duplica. Como resultado, la velocidad inicial de reacción también se duplicó (piense en ello como 21), por lo que puede concluir y = 1. Para las pruebas 1 y 2, la concentración de NO se duplica mientras que la concentración de H2 permanece constante. El resultado de este cambio es que la tasa inicial se cuadruplicó (piénselo como 22). Por lo tanto, puede concluir que x = 2.
Por lo tanto, la ley de velocidad para esta reacción es:
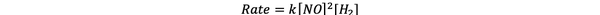
•••Adaptado de https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
Y la reacción es primer orden en H2 y segundo orden en NO.
