Ένας χημικός τύπος είναι μια απλοποιημένη, τυπική σημείωση για την εξήγηση μιας χημικής αντίδρασης που χρησιμοποιείται σε πειράματα. Μπορεί να φαίνονται περίπλοκα, αλλά όταν μάθετε πώς να τα διαβάσετε, γίνονται αρκετά αυτονόητα.
Κοιτάξτε τη χημική αντίδραση που προσπαθείτε να αναλύσετε ως εξίσωση. Αναζητήστε βασικές λέξεις, ειδικά τα χημικά συστατικά που εμπλέκονται. Για παράδειγμα, το μεθάνιο (CH4) καίγεται, πράγμα που σημαίνει πάντα ότι γίνεται με οξυγόνο (O2). Αυτό παράγει ατμούς διοξειδίου του άνθρακα (CO2) και νερού (H2O). Σημειώστε τη θέση της λέξης "Αποδόσεις", καθώς αυτή είναι σημαντική.
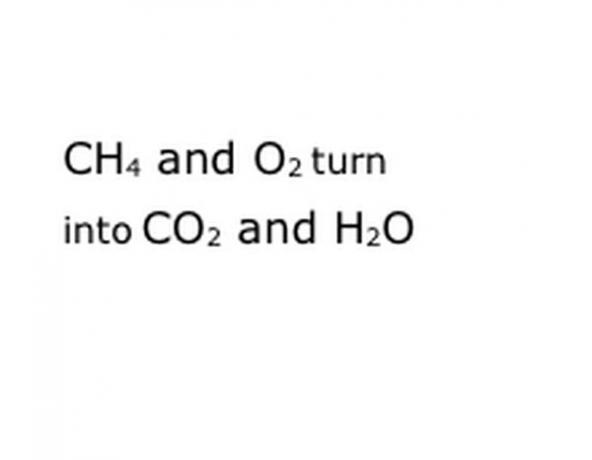
Γράψτε τα χημικά συστατικά της αντίδρασης στην τυπική μορφή σημειογραφίας. Στο παράδειγμά μας, αυτό θα είναι CH4, O2, CO2 και H2O. Στη χημεία, η «απόδοση» σημαίνει ότι ό, τι είναι πριν μετατραπεί σε ό, τι ακολουθεί, οπότε βεβαιωθείτε ότι η «απόδοση» είναι περίπου στη μέση. Αυτή η φράση θα αντιπροσωπεύει την πραγματική χημική αντίδραση, στην περίπτωση αυτή το κάψιμο. Οπότε, ό, τι θα κάψετε πρέπει να είναι πριν, και οτιδήποτε αποφέρει η αντίδραση πρέπει να είναι μετά.
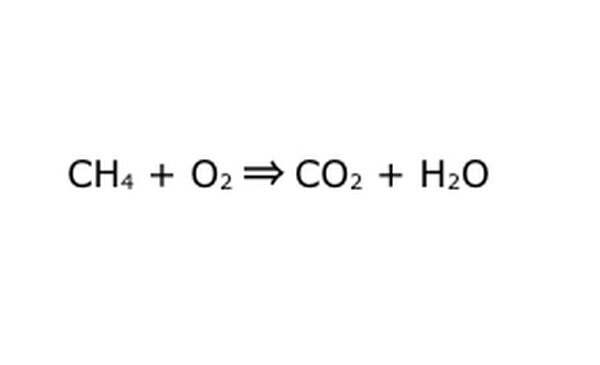
Ξαναγράψτε την εξίσωση ως μαθηματική διαδικασία. Αντικαταστήστε το "απόδοση" ή το "μετατρέπεται σε" με ένα βέλος και σχεδιάστε σύμβολα συν μεταξύ των χημικών συστατικών. Για να απλοποιήσετε τα πράγματα, σκεφτείτε κάθε χημικό συστατικό ως ξεχωριστό μόριο. Μπορεί να βοηθήσει να βγάλουμε τα μόρια σε ένα κομμάτι απορριμμάτων χαρτιού. Βεβαιωθείτε ότι όλα τα μόρια που εισέρχονται απεικονίζονται βγαίνουν. Εάν υπάρχει κάτι που λείπει από το τελικό προϊόν, μπορείτε να το προσθέσετε με τρόπο που έχει νόημα - ελέγξτε οτιδήποτε γνωρίζετε ό, τι γνωρίζετε για την ομοιοπολική σύνδεση. Καθώς τα περισσότερα πειράματα γίνονται στην κανονική ατμόσφαιρα, μπορείτε να προσθέσετε O2 εάν είναι απαραίτητο σε αντιδράσεις καύσης. Εάν η εξίσωση είναι αναστρέψιμη, βεβαιωθείτε ότι έχει ένα διπλό βέλος για να το αντιπροσωπεύσετε.
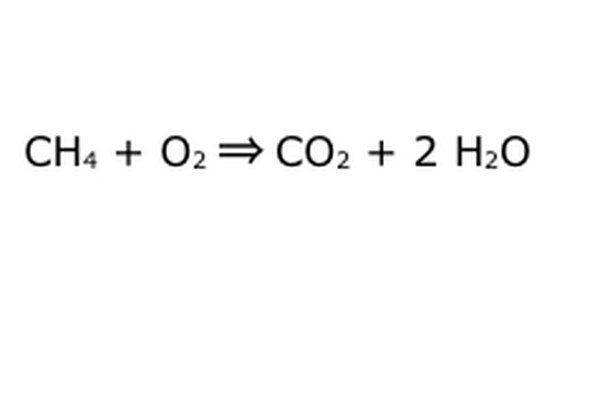
Ισορροπήστε την εξίσωση σας. Εδώ μπαίνει ο νόμος της διατήρησης: σκεφτείτε το βέλος, την αντίδρασή μας, ως μια μηχανή στην οποία έχετε απορρίψει όλα τα στοιχεία στα αριστερά. Το μηχάνημα δεν θα φτιάξει ούτε θα προσθέσει τίποτα που δεν βάλατε και επομένως θα ρίξει μόνο την ίδια ποσότητα που βάζετε. Σε αυτήν την ακριβή στιγμή, έχουμε δύο περίσσεια μορίων υδρογόνου που κυμαίνονται γύρω, επειδή βάλατε το "4". Το μόνο μέρος που μπορεί να πάει σε αυτό το μηχάνημα είναι σε ένα από τα προϊόντα, οπότε θα πρέπει να πάει στα μόρια του νερού. Γράψτε ένα "2" μπροστά από το H2O για να δείξετε ότι για κάθε CH4 που βάζετε, θα λάβετε δύο H2O πίσω.

Σημειώστε ότι υπάρχει ακόμα ένα μικρό πρόβλημα με την εξίσωση μας: δεν υπάρχει αρκετό οξυγόνο. Υπάρχουν τέσσερα άτομα οξυγόνου που βγαίνουν, αλλά μόνο δύο εισέρχονται, και έτσι το όλο θέμα εξακολουθεί να είναι ισορροπημένο. Γράψτε ένα "2" μπροστά από το O2 για να δηλώσετε ότι πρέπει να βάλετε δύο O2 για να βγείτε αρκετά από την αντίδραση.
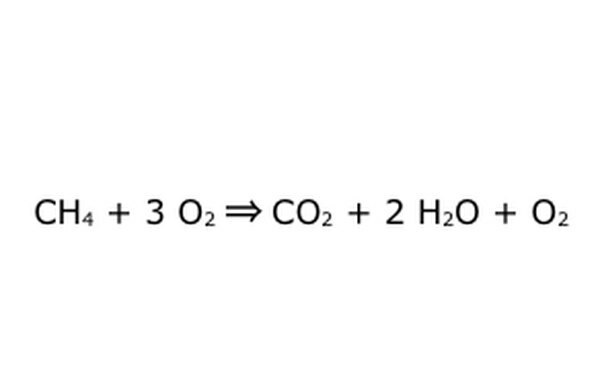
Σημειώστε ότι είναι δυνατόν να κάνετε μια τέτοια διαδικασία "σε περίσσεια οξυγόνου". Αυτό σημαίνει ότι η εξίσωση βάζει περισσότερο οξυγόνο από ό, τι χρειάζεται και επιστρέφει περισσότερο. Για παράδειγμα, σημειώστε ότι υπάρχει ένα επιπλέον O2, οπότε υπάρχει ένα επιπλέον που βγαίνει. Απλά βεβαιωθείτε ότι ο Νόμος της Διατήρησης τηρείται πάντα. Οτιδήποτε μπαίνει πρέπει να βγει.
Συμβουλές
Γενικά, οι χημικές ουσίες σε αυτούς τους τύπους εξισώσεων μετρούνται σε γραμμομόρια. Το mole είναι μια μονάδα που αντιπροσωπεύει 6.0221415 10 ^ (23) μόρια. Δεδομένου ότι αυτός είναι ένας αριθμός πολύ μεγάλος για κατανόηση, είναι ευκολότερο να σκεφτεί κανείς μεμονωμένα μόρια κατά την εξισορρόπηση. Λάβετε υπόψη αυτό κατά την έναρξη.
