Кинетиката е клонът на физическата химия, който изучава скоростта на химичните реакции. За разлика от това, термодинамиката ни казва коя посока на реакцията е предпочитана, без да разкрива нейната скорост на реакция. Някои реакции могат да бъдат термодинамично облагодетелствани, но кинетично нежелани.
Например при превръщането на диаманта в графит графитът има по-ниска свободна енергия от диаманта, така че преобразуването е термодинамично благоприятно. Съществува обаче голяма бариера за активиране, за да може диамантът да се счупи и да реформира всички връзки стабилна графитна конфигурация, поради което тази реакция е кинетично неблагоприятна и всъщност няма да се случи.
Скорост на реакция
The скорост на реакция е мярка за това колко бързо се образуват продуктите и консумират реагентите, така че можете да го определите чрез измерване на промяната в концентрацията на продуктите или реагентите за определен период от време. Помислете за обща химическа реакция:
aA + bB> cC + dD
Скоростта на реакцията може да бъде записана като:
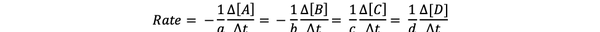
•••Променено от https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
Например скоростта на реакция за:
2 NO (g) + 2H2 (g)> N2(g) + 2Н2O (g)
се дава от
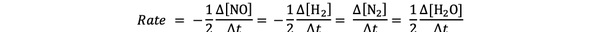
•••Адаптиран от https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
За да определите скоростта на тази реакция чрез експеримент, можете да измерите концентрацията на Н2 по различно време на реакцията и го начертайте спрямо времето, както следва:
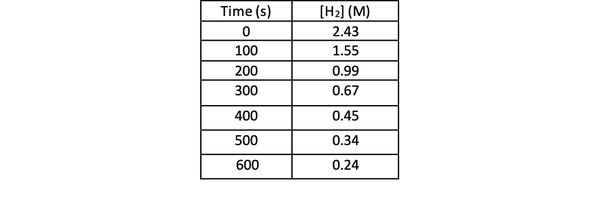
•••Променено от https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
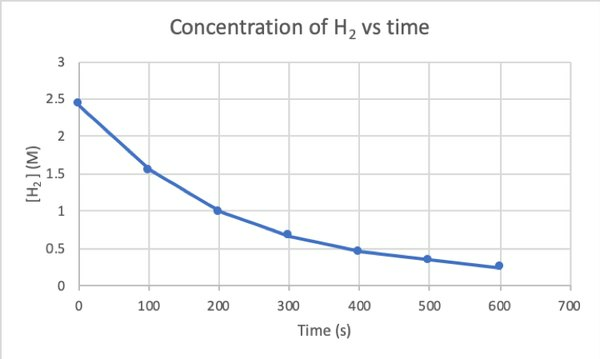
•••Променено от https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
The средна скорост на реакция е приближение на скоростта на реакцията във времеви интервал и може да се обозначи с:
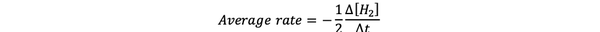
•••Променено от https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
The моментална скорост на реакция се определя като скорост на реакция в даден момент от времето. Това е диференциална ставка и може да се изрази чрез:
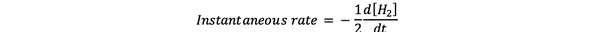
•••Променено от https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
Където d [H2] / dt е наклонът за кривата на концентрация на H2 спрямо времето в момент t.
The начална скорост на реакция е моментната скорост в началото на реакцията, когато t = 0. В този случай, мерна единица за средна, моментна и начална скорост на реакция е M / s.
Оценете закона
В повечето случаи скоростта на реакцията зависи от концентрацията на различните реактиви в момент t. Например, при по-висока концентрация на всички реагенти, реагентите се сблъскват по-често и водят до по-бърза реакция. Връзката между скоростта на реакция ν (t) и концентрациите се определя като ставка закон. А законът за скоростта на общата химична реакция aA + bB> cC + dD е:
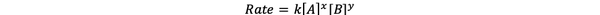
•••Променено от https://chem.libretexts.org/Bookshelves/Ancillary_Materials/Laboratory_Experiments/Wet_Lab_Experiments/General_Chemistry_Labs/Online_Chemistry_Lab_Manual/Chem_12_Experiments/01%3A_Chemical_Kinetics_-_The_Method_of_Initial_Rates_(Experiment)
Където k е константата на скоростта, а мощността x и y е поръчка на реакцията по отношение на реагент А и В. Законът за скоростта трябва да бъде определен експериментално и не може да бъде изведен само от стехиометрията на балансирана химическа реакция.
Метод на първоначалните цени
Законът за лихвения процент може да бъде определен от метод на първоначалните ставки. При този метод експериментът се извършва многократно, като се променя само концентрацията на един реагент за всеки цикъл, като се поддържат постоянни други променливи. Скоростта на реакцията се измерва за всеки цикъл, за да се определи редът на всеки реагент в закона за скоростта.
Например, вземете предвид следните първоначални данни за скоростта на реакцията:
2 NO (g) + 2H2 (g)> N2(g) + 2Н2O (g)
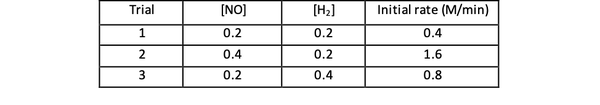
•••Адаптиран от https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
За проби 1 и 3 концентрацията на NO се поддържа постоянна, докато концентрацията на Н2 се удвоява. В резултат на това първоначалната скорост на реакция също се удвои (помислете за 21), така че можете да заключите y = 1. За проби 1 и 2 концентрацията на NO се удвоява, докато концентрацията на Н2 остава постоянна. Резултатът от тази промяна е, че първоначалният лихвен процент се е утроил (помислете за 22). Следователно можете да заключите x = 2.
Следователно законът за скоростта на тази реакция е:
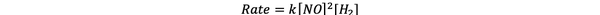
•••Адаптиран от https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
И реакцията е първа поръчка в Н2 и втора поръчка в НЕ.
