الصيغة الكيميائية عبارة عن تدوين قياسي مبسط لشرح تفاعل كيميائي مستخدم في التجارب. قد تبدو معقدة ، ولكن عندما تتعلم كيفية قراءتها ، فإنها تصبح إلى حد ما تشرح نفسها بنفسها.
انظر إلى التفاعل الكيميائي الذي تحاول تفكيكه كمعادلة. ابحث عن الكلمات الرئيسية ، وتحديدًا المكونات الكيميائية المعنية. على سبيل المثال ، يتم حرق الميثان (CH4) ، مما يعني دائمًا أنه يتم في الأكسجين (O2). ينتج عن ذلك كلاً من ثاني أكسيد الكربون (CO2) وبخار الماء (H2O). لاحظ موقع كلمة "محاصيل" ، لأن هذا مهم.
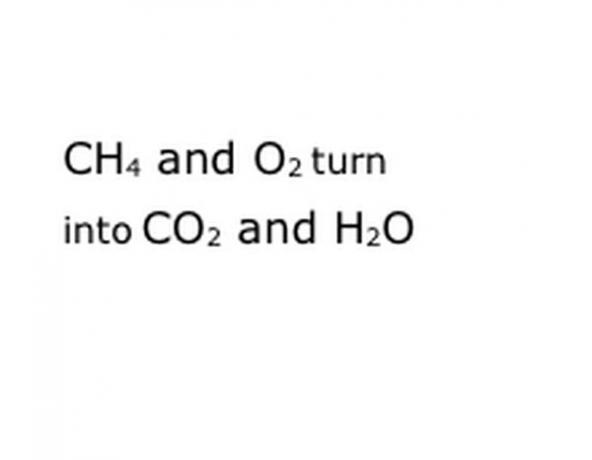
اكتب المكونات الكيميائية للتفاعل في صيغة الترميز القياسي. في مثالنا ، سيكون هذا CH4 و O2 و CO2 و H2O. في الكيمياء ، تعني كلمة "الإنتاجية" أن كل ما كان قبله يتحول إلى ما يأتي بعد ذلك ، لذا تأكد من أن "العائد" في المنتصف تقريبًا. ستمثل هذه العبارة التفاعل الكيميائي الفعلي ، وفي هذه الحالة الاحتراق. لذا فإن أي شيء ستحرقه يجب أن يكون أمامه ، وأي شيء ينتج عنه التفاعل يجب أن يكون بعده.
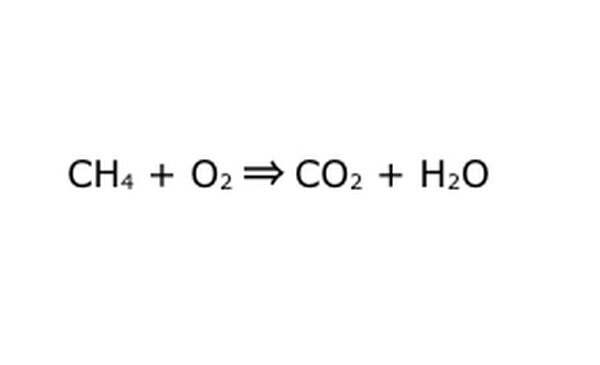
أعد كتابة المعادلة كعملية رياضية. استبدل "العائد" أو "يتحول" بسهم ، وارسم علامات الجمع بين المكونات الكيميائية. لتبسيط الأمور ، فكر في كل مكون كيميائي على أنه جزيء فردي. قد يساعد سحب الجزيئات على قطعة من الورق الخردة. تأكد من أن جميع الجزيئات التي تدخل يتم تمثيلها في الخارج. إذا كان هناك شيء مفقود من المنتج النهائي ، فيمكنك إضافة ذلك بطريقة منطقية - تحقق من أي شيء مقابل ما تعرفه عن الترابط التساهمي. نظرًا لأن معظم التجارب تتم في الغلاف الجوي العادي ، يمكنك إضافة O2 إذا لزم الأمر إلى تفاعلات الاحتراق. إذا كانت المعادلة قابلة للعكس ، فتأكد من احتوائها على سهم مزدوج لتمثيل ذلك.
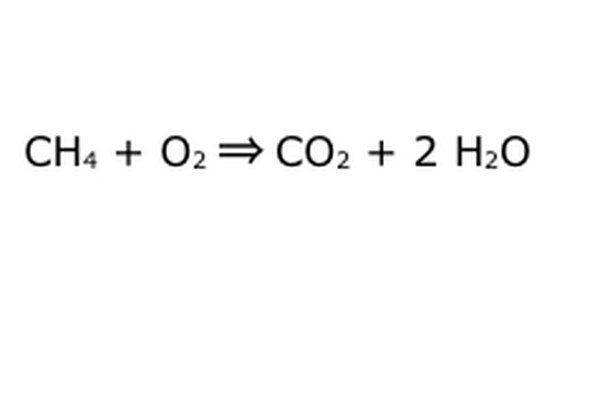
وازن معادلتك. هنا يأتي دور قانون الحفظ: فكر في السهم ، رد فعلنا ، كآلة قمت بإلقاء جميع المكونات الموجودة على اليسار فيها. لن تصنع الآلة أو تضيف أي شيء لم تضعه ، وبالتالي لن تقوم إلا بإخراج نفس الكمية من الأشياء التي تضعها. في هذه اللحظة بالتحديد ، لدينا جزيئين هيدروجين زائدين يطفوان ، لأنك وضعت "4" فيها. المكان الوحيد الذي يمكن أن يدخله في هذا الجهاز هو أحد المنتجات ، لذلك سيتعين عليه الدخول في جزيئات الماء. اكتب "2" أمام H2O للإشارة إلى أنه مقابل كل CH4 تضعه ، ستحصل على اثنين من H2O.

لاحظ أنه لا تزال هناك مشكلة صغيرة في معادلتنا: لا يوجد ما يكفي من الأكسجين الداخل. هناك أربع ذرات أكسجين تخرج ، ولكن اثنتان فقط تدخلان ، وبالتالي فإن الأمر برمته لا يزال غير متوازن. اكتب "2" أمام O2 لتمثل أنه يجب عليك وضع اثنين من O2 للحصول على ما يكفي من رد الفعل.
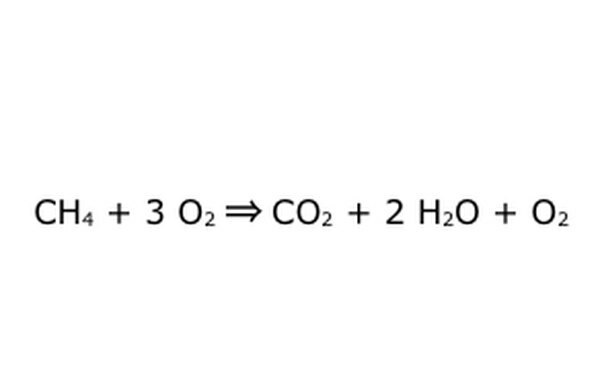
لاحظ أنه من الممكن القيام بعملية مثل هذه "بكميات زائدة من الأكسجين". ما يعنيه هذا هو أن المعادلة تضع كمية من الأوكسجين أكثر مما هو مطلوب ، وتستعيد كمية أكبر. على سبيل المثال ، لاحظ أن هناك O2 إضافي يدخل ، لذلك هناك خروج إضافي. فقط تأكد من مراعاة قانون الحفظ في جميع الأوقات. أي شيء يدخل يجب أن يخرج.
نصائح
بشكل عام ، يتم قياس المواد الكيميائية في هذه الأنواع من المعادلات بالمولات. المول هو وحدة تمثل 6.0221415 10 ^ (23) جزيء. نظرًا لأن هذا الرقم أكبر من أن نفهمه ، فمن الأسهل التفكير من حيث الجزيئات المفردة عند الموازنة. كن على علم بهذا عند البدء.
