En kemisk formel är en förenklad standardnotation för att förklara en kemisk reaktion som används i experiment. De kan se komplicerade ut, men när du lär dig att läsa dem blir de ganska självförklarande.
Titta på den kemiska reaktion du försöker bryta ner som en ekvation. Leta efter nyckelord, särskilt de berörda kemiska komponenterna. Till exempel bränns metan (CH4), vilket alltid betyder att det görs i syre (O2). Detta ger både koldioxid (CO2) och vatten (H2O) ånga. Observera placeringen av ordet "Avkastning", eftersom detta är viktigt.
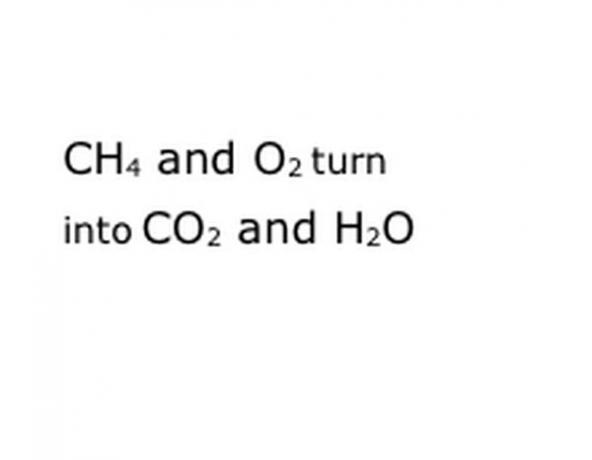
Skriv reaktionens kemiska komponenter i standardnotationsformatet. I vårt exempel kommer detta att vara CH4, O2, CO2 och H2O. I kemi betyder "avkastning" att allt som är innan blir till vad som kommer efter, så var säker på att "avkastning" är ungefär i mitten. Den frasen kommer att representera den faktiska kemiska reaktionen, i detta fall brännandet. Så allt som du kommer att bränna måste vara innan det, och allt som reaktionen ger måste vara efter.
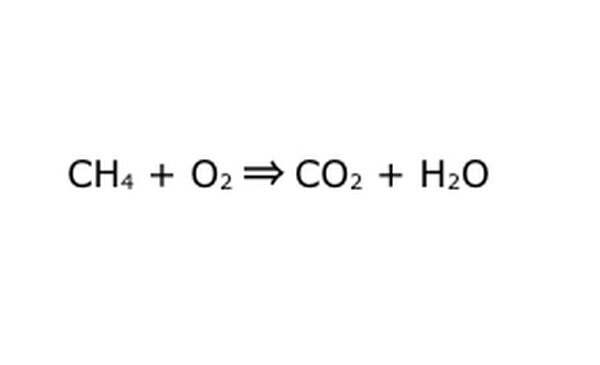
Skriv om ekvationen som en matematisk process. Byt ut "utbyte" eller "förvandlas till" med en pil och rita plustecknen mellan de kemiska komponenterna. För att förenkla saker, tänk på varje kemisk komponent som en enskild molekyl. Det kan hjälpa att dra ut molekylerna på en bit papper. Se till att alla molekyler som går in representeras kommer ut. Om det saknas något i slutprodukten kan du lägga till det på ett sätt som är vettigt - kontrollera vad som helst mot vad du vet om kovalent bindning. Eftersom de flesta experiment görs i den vanliga atmosfären kan du lägga till O2 om det behövs för att bränna reaktioner. Om ekvationen är reversibel, se till att den har en dubbelpil för att representera det.
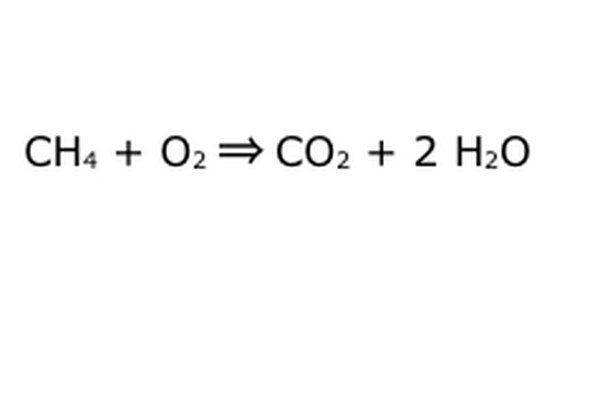
Balansera din ekvation. Det är här Conservation Law kommer till spel: tänk på pilen, vår reaktion, som en maskin som du har dumpat alla komponenter till vänster i. Maskinen kommer inte att tillverka eller lägga till någonting som du inte har lagt in, och därför kommer det bara att spotta ut samma mängd saker du sätter i. I detta exakta ögonblick har vi två överflödiga vätemolekyler som flyter runt, eftersom du sätter in "4". Det enda stället det kan gå i den här maskinen är i en av produkterna, så den måste gå in i vattenmolekylerna. Skriv en "2" framför H2O för att indikera att för varje CH4 du sätter in får du två H2O tillbaka.

Observera att det fortfarande finns ett litet problem med vår ekvation: det går inte tillräckligt med syre. Det kommer fyra syreatomer ut, men bara två går in, och så är det hela fortfarande obalanserat. Skriv en "2" framför O2 för att representera att du måste sätta in två O2 för att få ut tillräckligt av reaktionen.
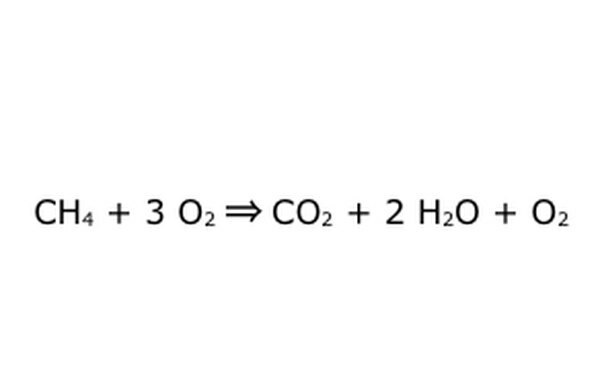
Observera att det är möjligt att göra en sådan process "i ett överskott av syre." Vad detta betyder är att ekvationen sätter in mer syre än vad som behövs och får mer tillbaka. Observera till exempel att det finns en extra O2 som går in, så det kommer en extra ut. Var bara säker på att lag om bevarande följs hela tiden. Allt som går in måste komma ut.
Tips
Generellt mäts kemikalier i dessa typer av ekvationer i mol. En mol är en enhet som representerar 6.0221415 10 ^ (23) molekyler. Eftersom detta är ett nummer som är alltför stort för att förstå, är det lättare att tänka i termer av enskilda molekyler när man balanserar. Var medveten om detta när du börjar.
