Вероватно сте се сусрели са празним батеријама, што представља сметњу ако их покушавате користити у електроничким уређајима. Хемијска ћелија батерија може вам рећи својства њиховог рада, укључујући и како се кваре.
Хемијска ћелија батерија
•••Сиед Хуссаин Атхер
Када електрохемијска реакција батерије испразни материјале, батерија се испразни. То се углавном дешава након дугог коришћења батерије.
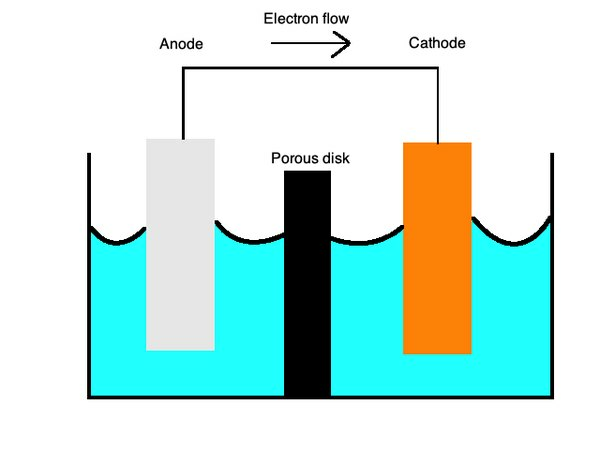
Батерије обично користе примарне ћелије, врстугалванска ћелијакоји користи два различита метала у течном електролиту како би омогућио пренос наелектрисања између њих. Позитивни набоји теку изкатода, грађена катионима или позитивно наелектрисаним јонима попут бакраанода, са анионима или негативно наелектрисаним јонима као што је цинк.
Савети
Батерије се празне услед исушивања хемикалија електролита у батерији. У случају алкалних батерија, тада је сав манган-диоксид претворен. У овој фази је батерија празна.
Да бисте се сетили ове везе, можете се сетити речи „ОИЛРИГ“. Ово вам говориоксидација је губитак(„УЉЕ“) и
Примарне ћелије такође могу да раде са појединачним полућелијама различитих метала у јонском раствору повезаном мостом соли или порозном мембраном. Ове ћелије пружају батеријама безброј употреба.
Алкалне батерије, који посебно користе реакцију између цинкове аноде и магнезијумове катоде, користе се за батеријске лампе, преносиве електронске уређаје и даљинске управљаче. Остали примери популарних елемената батерија укључују литијум, живу, силицијум, сребрни оксид, хромну киселину и угљеник.
Инжењерски дизајн може искористити начин на који се батерије смањују за уштеду и поновну употребу енергије. Јефтине кућне батерије обично користе ћелије од угљен-цинка дизајниране тако да, ако цинк подлежегалванска корозија, поступак у којем метал пожељно кородира, батерија може производити електричну енергију као део затвореног електронског кола.
На којој температури експлодирају батерије? Хемијска ћелија литијум-јонских батерија значи да ове батерије започињу хемијске реакције које резултирају експлозијом на око 1.000 ° Ц. Бакарни материјал унутар њих се топи што доводи до лома унутрашњих језгара.
Историја хемијске ћелије
1836. године британски хемичар Јохн Фредериц Даниелл конструисао јеДаниелова ћелијау којој је користио два електролита, уместо само једног, како би дозволио да други производи водоник који производи један. Уместо сумпорне киселине користио је цинков сулфат, уобичајену праксу батерија тог доба.
Пре тога, научници су користили волтаичне ћелије, врсту хемијских ћелија које користе спонтану реакцију, која је великом брзином губила снагу. Даниелл је користио преграду између бакарне и цинкове плоче како би спречио да вишак водоника пукне и спречио брзо трошење батерије. Његов рад довео би до иновација у телеграфији и електрометалургији, методу коришћења електричне енергије за производњу метала.
Како се пуне батерије пуне
Секундарне ћелије, с друге стране, могу се пунити. Пуњива батерија, која се назива и акумулатор, секундарна ћелија или акумулатор, складишти пуњење током времена, док су катода и анода повезане у круг једни с другима.
Током пуњења позитивни активни метал, као што је хидроген-оксид никл-оксида, оксидира, стварајући електроне и губе их, док се негативни материјал попут кадмијума смањује, хвата електроне и добија њих. Батерија користи циклусе пуњења-пражњења користећи различите изворе, укључујући наизменичну струју као спољни извор напона.
Пуњиве батерије и даље могу да се покваре након поновљене употребе јер материјали који учествују у реакцији губе способност пуњења и поновног пуњења. Како се ови системи батерија троше, постоје различити начини на које се батерије испразне.
Како се батерије користе рутински, неке од њих, попут оловно-киселинских, могу изгубити способност поновног пуњења. Литијум литијум-јонских батерија може постати реактивни литијум метал који не може поново да уђе у циклус пражњења наелектрисања. Батерије са течним електролитима могу смањити влагу услед испаравања или прекомерног пуњења.
Примене пуњивих батерија
Ове батерије се обично користе у аутомобилским стартерима, инвалидским колицима, електричним бициклима, електричним алатима и електранама за складиштење батерија. Научници и инжењери проучавали су њихову употребу у хибридним батеријама са унутрашњим сагоревањем и електричним возилима како би постали ефикаснији у својој потрошњи енергије и трајали дуже.
Пуњива оловна киселина разбија молекуле воде (Х.2О.) у водени раствор водоника (Х.+) и оксидни јони (О.2-) који из раскида везе производи електричну енергију како вода губи набој. Када водени раствор водоника реагује са овим оксидним јонима, јаке О-Х везе се користе за напајање батерије.
Физика реакција батерија
Ова хемијска енергија покреће редокс реакцију која претвара високоенергетске реактанте у производе мање енергије. Разлика између реактаната и производа омогућава реакцији и формира електрични круг када се батерија прикључи претварањем хемијске енергије у електричну.
У галванској ћелији реактанти, попут металног цинка, имају високу слободну енергију која омогућава да се реакција спонтано догоди без спољне силе.
Метали који се користе у аноди и катоди имају кохезивну енергију решетке која може да покреће хемијску реакцију. Кохезивна енергија решетке је енергија потребна за одвајање атома који чине метал један од другог. Често се користе метални цинк, кадмијум, литијум и натријум јер имају високе енергије јонизације, минималну енергију потребну за уклањање електрона из елемента.
Галванске ћелије које покрећу јони истог метала могу да користе разлике у слободној енергији да изазову Гиббсову слободну енергију да покреће реакцију. ТхеГиббсова бесплатна енергијаје други облик енергије који се користи за израчунавање количине рада који термодинамички процес користи.
У овом случају, промена у стандардној Гиббсовој слободној енергијиГ.о покреће напон или електромоторну силуЕ.оу волтима, према једначини
Е ^ {\ тект {о}} = \ фрац {- \ Делта_рГ ^ {\ тект {о}}} {в_еФ}
у којимавеје број електрона пренетих током реакције и Ф је Фарадејева константа (Ф = 96485,33 Ц мол−1).
ТхеΔрГ.о указује да једначина користи промену Гибсове слободне енергије (ΔрГ.о =Г.коначни - Г.почетни).Ентропија се повећава како реакција користи расположиву слободну енергију. У Даниелл-овој ћелији разлика у кохезивној енергији решетке између цинка и бакра чини већину Гиббс-ове разлике у слободној енергији како се реакција догоди.ΔрГ.о= -213 кЈ / мол, што је разлика у Гиббсовој слободној енергији производа и енергије реактаната.
Напон галванске ћелије
Ако одвојите електрохемијску реакцију галванске ћелије на половичне реакције оксидације и редукције процеса, можете сумирати одговарајуће електромоторне силе да бисте добили укупну разлику напона кориштену у ћелија.
На пример, типична галванска ћелија може да користи ЦуСО4 и ЗнСО4 са стандардним потенцијалним половичним реакцијама као:Цу2+ + 2 е− ⇌ Цуса одговарајућим електромоторним потенцијаломЕ.о = +0,34 В.иЗн2+ + 2 е− ⇌ Знса потенцијаломЕ.о = −0,76 В.
За укупну реакцију,Цу2+ + Зн ⇌ Цу + Зн2+ , можете "преокренути" половину реакционе једначине цинка док окрећете знак електромоторне силе да бисте добилиЗн ⇌ Зн2+ + 2 е− саЕ.о = 0,76 В.Укупан потенцијал реакције, збир електромоторних сила, је тада+0,34 В. - (−0,76 В) = 1,10 В.
