Ogljik je nekovinski element s kemijskim simbolom C. Je četrti najbolj razširjeni element v vesolju in 15. najbolj razširjeni element v zemeljski skorji. Je tudi drugi najpogostejši element v človeku za kisikom. Njegova kemična sestava vodi do več edinstvenih lastnosti ogljika.
Ogljik spada v skupino 14 periodnega sistema. Njegovo atomsko število je 6 in ima atomsko težo 12.011. Stopnje oksidacije ogljika se lahko gibljejo od -4 do +4, kjer +4 obstaja v spojinah, kot sta metan in ogljikov disulfid, in +2 za ogljikov monoksid.
Zaradi fizikalnih lastnosti različnih ogljikovih alotrop so uporabne v baterijah, elektroniki in nanomaterialih. Ogljik je tudi "kralj elementov", ki se skoraj oblikuje 10 milijonov spojin do danes, vključno z organskimi, anorganskimi in organometalnimi spojinami.
Izotopi ogljika se pogosto uporabljajo za radiokarbonsko datiranje (ogljik-14), molekularno strukturo in medicinske raziskave (ogljik-13). Poleg tega imajo ogljikova vlakna odlične mehanske lastnosti in so priljubljena v vesoljski in gradbeni industriji.
Ogljikove alotrope
Ogljik ima drugačno alotropne oblike, z različnimi molekularnimi konfiguracijami in atomskimi strukturami. Fizične lastnosti ogljika se pri vsaki alotropi močno razlikujejo. Nekateri najbolj znani alotropi ogljika vključujejo grafit, diamant in fulerene.
Grafit je eden najmehkejših znanih materialov in se uporablja v svinčnikih in kot trdno mazivo. Je tudi dober prevodnik električne energije, zaradi česar je koristen v baterijah in sončnih kolektorjih.
Grafen je preprosto ena atomska plast grafita, razporejena v satjasto mrežo. V grafenski plasti je vsak atom ogljika kovalentno vezan na tri druge atome, tako da četrti elektron prosto seli v ravnini, od tod tudi njegova električna prevodnost.
Nasprotno, diamant je najtrša snov, ki se naravno pojavlja in je ena od edinstvenih lastnosti ogljika. Ima skoraj dvakrat večjo gostoto grafita in vsak atom ogljika je tetraedrično vezan na štiri druge brez prostega elektrona. Tako je diamant slab prevodnik električne energije. Diamant je tudi na videz jasen, za razliko od grafita, ki je neprozoren.
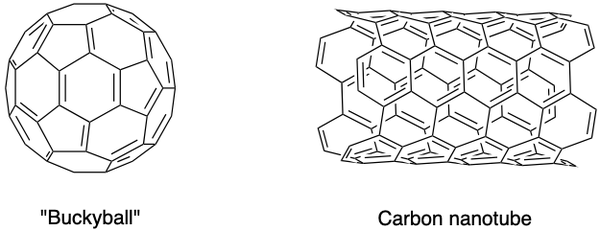
Znanstveniki so sintetizirali tudi druge alotrope ogljika, kot so fulereni, ogljikove nanopene in druge. Imajo posebne lastnosti in predstavljajo cvetoče področje raziskav v Ljubljani nanomateriali. Fulereni so skupina votlih molekul ogljika v konformaciji zaprte kletke (backyball) ali valja (ogljikove nanocevke).
•••Ustvarjeno s pomočjo ChemDraw
C60 buckyball so odkrili Sir Harold Kroto, Richard Smalley in Robert Curl Jr., z laserjem za uparjanje grafitnih palic v atmosferi helija. Atomi ogljika so združeni z enojnimi in dvojnimi vezmi, da tvorijo 12 peterokotnih in 20 šesterokotnih obrazov v obliki nogometne žoge. Njihova pionirska prizadevanja so jim leta 1996 prinesla Nobelovo nagrado.
Iijima Sumio je identificiral ogljikove nanocevke, ki so podolgovate različice lopov. So odlični prevodniki toplote in električne energije in so uporabni za elektroniko.
Ogljikove nanocevke kažejo tudi impresivno natezno trdnost in imajo razburljivo uporabo v strukturnih materialih in medicini. Vendar pa je nadzorovana sinteza takšnih nanomaterialov za znanstvenike predstavljala velik izziv.
Kemijska reaktivnost ogljika
Ogljik je osnova življenja na Zemlji, saj milijoni spojin, ki vsebujejo ogljik, predstavljajo 18 odstotkov vseh živih bitij. Lahko tvori stabilne, kovalentne vezi z drugimi atomi in so videti kot dolge verige ali obroči močnih medsebojno povezanih vezi ogljik-ogljik. Ti prispevajo k raznolikosti in kompleksnosti ogljikovih spojin, ki obstajajo na Zemlji.
Te ogljikove spojine vključujejo organske molekule, kot so beljakovine, ogljikovi hidrati in DNA, ki jih najdemo v celicah živih organizmov, pa tudi anorganske spojine, kot so ogljikovi oksidi. Preučevanje organskih molekul predstavlja specializirano področje, imenovano organska kemija. Ogljik lahko tvori tudi kovalentne vezi s kovino kot organometalne spojine. Tak primer je železov porfirin, ki je mesto vezave kisika hemoglobina.
Kljub svoji številni naravi je ogljik v običajnih pogojih razmeroma nereaktiven. Pri standardni temperaturi ni reaktiven za kisline (žveplovo ali klorovodikovo kislino) ali alkalije. Tudi pri tej temperaturi je stabilen na oksidacijo. Pri višjih temperaturah pa lahko ogljik reagira s kisikom in tvori ogljikove okside (CO2 in CO), z žveplovim plinom za tvorbo ogljikovega disulfida in s silicijem za tvorbo karbidov.
Izotopi ogljika
Znanih je 15 izotopov ogljika, med katerimi sta ogljik-12 (98,93 odstotka naravnega ogljika) in ogljik-13 (1,07 odstotka) dva stabilna izotopa. Ogljik-14 je najdlje živeči izotop z razpolovno dobo 5.730 let. Najkrajši živi ogljikov izotop je ogljik-8 in ima razpolovno dobo 1,98739 x 10−21 sekund.
Izotop ogljik-14 predstavlja 146C, kjer je predpopis 14 atomska masa, predpopis 6 pa atomsko število. Ogljik-14 ima zelo malo naravne številčnosti (0,0000000001 odstotkov), vendar je zaradi njegove dolge razpolovne dobe koristen za radiometrično datiranje.
Ogljik-14 nastane, ko dušik-14 reagira z nevtroni iz kozmičnega sevanja in v tem procesu sprosti proton. Ogljik-14 nato reagira s kisikom, da nastane 14CO2, ki se v ozračju enakomerno porazdeli s 12CO2.
147N + 10n> 146C + 11str
Ogljikov cikel se začne, ko živi organizmi pretvorijo ogljikov dioksid (14CO2 in 12CO2 iz atmosfere) v organske spojine s fotosintezo in jo z dihanjem sprostite nazaj v ozračje. V tem ravnovesju je določeno razmerje 14CO2 in 12CO2 v organizmih. Ko pa umrejo, se ravnovesje ustavi in ogljik-14 se beta razgradi do dušika-14 v skladu s 5.730 letnim razpolovnim časom.
146C> 147N + 0-1e
Merjenje relativnega deleža ogljika-14 v odmrlem primerku tako omogoča izračun časa, ki je pretekel po njegovi smrti. Ta metoda radiokarbonskega datiranja se pogosto uporablja za datiranje fosilov in arheoloških primerkov, starih od 500 do 50.000 let.
Ogljik-13 je še en izotop, ki se pogosto uporablja v mnogih aplikacijah. Na primer, uporablja se v jedrski magnetni resonanci (NMR) za določanje molekularnih struktur organskih spojin. Uporablja se tudi kot orodje za označevanje v kombinaciji z masnim spektrometrom za medicinske raziskave.
Mehanske lastnosti ogljikovih vlaken
Ogljik ima poleg uporabnih mehanskih lastnosti poleg fizikalnih, kemijskih in jedrskih lastnosti.
Lahko se oblikuje zlitine z jeklom v ogljikovo jeklo, katerega vsebnost ogljika se giblje od 0,05 do 2 mas.%. Srednjeogljično jeklo (0,3-0,6 odstotka ogljika) ima uravnoteženo trdnost in duktilnost ter odlično natezno trdnost. S postopkom toplotne obdelave lahko ultra-ogljikovo jeklo (1,25-2 odstotka ogljika) kaljemo do velike trdote in uporabimo za izdelavo nožev.
Ogljikova vlakna, ki so od 5 do 10 μm debela vlakna, sestavljena večinoma iz atomov ogljika, kažejo visoko togost, natezna trdnost, kemična odpornost, temperaturna toleranca in majhna teža ter toplotna širitev. Meja raztezanja jekla je odvisna od njegove kakovosti, blago jeklo pa ima mejo raztezanja 247 MPa. Ogljikova vlakna imajo natezne trdnosti od 1.600 do 6.370 MPa in so zato priljubljene na področju vesoljske, gradbene in šport.
Kadar na material deluje stres, se ta najprej elastično deformira. Na tej stopnji se lahko po odstranitvi stresa vrne v prvotno obliko. Moč donosa je definirana kot napetost, ki jo material prenese brez trajnih deformacij.
Ko doseže točko (zgornjo mejo tečenja), kjer se ne more več vrniti v prvotne dimenzije, je podvržen plastični deformaciji, ki je trajna in nepopravljiva. Natezna trdnost je največja trdnost, ki jo material lahko prenese, ne da bi se okvaril ali zlomil.
