Kinetika je veja fizikalne kemije, ki preučuje hitrost kemijskih reakcij. V nasprotju s tem pa termodinamika pove, kateri smeri reakcije je naklonjena, ne da bi razkrila njeno hitrost reakcije. Nekatere reakcije so lahko termodinamično naklonjene, vendar kinetično naklonjene.
Na primer, pri pretvorbi diamanta v grafit ima grafit nižjo prosto energijo kot diamant, zato je pretvorba termodinamično naklonjena. Vendar obstaja velika aktivacijska ovira, da lahko diamant zlomi in še bolj reformira vse vezi stabilna konfiguracija grafita, zato je ta reakcija kinetično naklonjena in se dejansko ne bo pojavila.
Stopnja reakcije
The hitrost reakcije je merilo, kako hitro nastajajo proizvodi in porabljajo se reaktanti, zato ga lahko določite z merjenjem spremembe koncentracije produktov ali reaktantov v določenem časovnem obdobju. Razmislite o splošni kemični reakciji:
aA + bB> cC + dD
Hitrost reakcije lahko zapišemo kot:
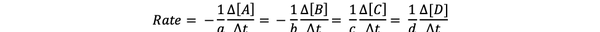
•••Spremenjeno iz https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
Na primer hitrost reakcije za:
2 NO (g) + 2 H2 (g)> N.2(g) + 2H2O (g)
je podano z
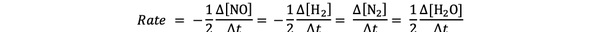
•••Prirejeno iz https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
Če želite s poskusom določiti hitrost te reakcije, lahko izmerite koncentracijo H2 v različnih časih reakcije in jo časovno razporedite na naslednji način:
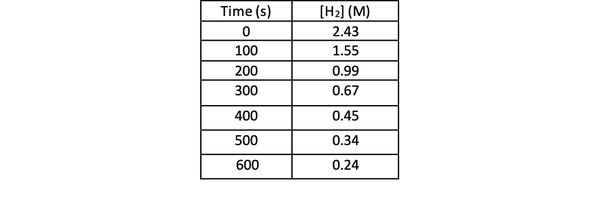
•••Spremenjeno iz https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
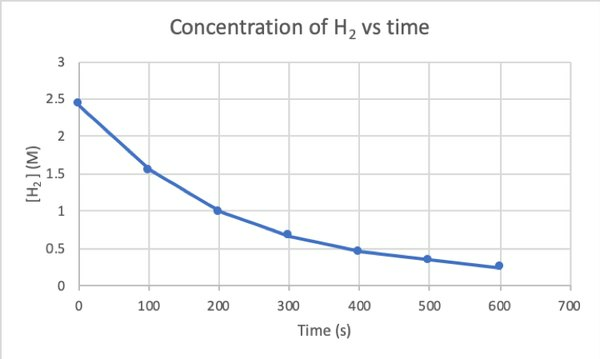
•••Spremenjeno iz https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
The povprečna hitrost reakcije je približek hitrosti reakcije v časovnem intervalu in ga lahko označimo z:
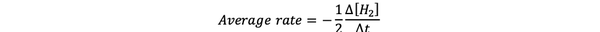
•••Spremenjeno iz https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
The trenutna hitrost reakcije je definirana kot hitrost reakcije v nekem trenutku. To je diferencialna stopnja in jo lahko izrazimo z:
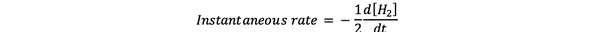
•••Spremenjeno iz https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
Kjer je d [H2] / dt je naklon krivulje koncentracije H2 v primerjavi s časom v času t.
The začetna hitrost reakcije je trenutna hitrost na začetku reakcije, ko je t = 0. V tem primeru je enota za povprečno trenutno in začetno hitrost reakcije je M / s.
Ocenite zakon
V večini primerov je hitrost reakcije odvisna od koncentracije različnih reagentov v času t. Na primer, pri višji koncentraciji vseh reaktantov reaktanti pogosteje trčijo in povzročijo hitrejšo reakcijo. Razmerje med hitrostjo reakcije ν (t) in koncentracijami je opredeljeno kot zakon o stopnjah. In zakon hitrosti za splošno kemično reakcijo aA + bB> cC + dD je:
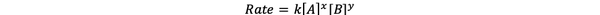
•••Spremenjeno iz https://chem.libretexts.org/Bookshelves/Ancillary_Materials/Laboratory_Experiments/Wet_Lab_Experiments/General_Chemistry_Labs/Online_Chemistry_Lab_Manual/Chem_12_Experiments/01%3A_Chemical_Kinetics_-_The_Method_of_Initial_Rates_(Experiment)
Kjer je k konstanta hitrosti, moč x in y pa naročilo reakcije glede na reaktant A in B. Zakon hitrosti je treba določiti eksperimentalno in ga ni mogoče razbrati zgolj iz stehiometrije uravnotežene kemične reakcije.
Metoda začetnih cen
Zakon o obrestni meri lahko določi metoda začetnih stopenj. Pri tej metodi se eksperiment izvede večkrat, pri čemer se samo spremeni koncentracija enega reaktanta za vsak potek, druge spremenljivke pa ostanejo konstantne. Hitrost reakcije se meri za vsak potek, da se določi vrstni red vsakega reaktanta v zakonu o hitrosti.
Na primer, upoštevajte naslednje začetne podatke o hitrosti reakcije:
2 NO (g) + 2 H2 (g)> N.2(g) + 2H2O (g)
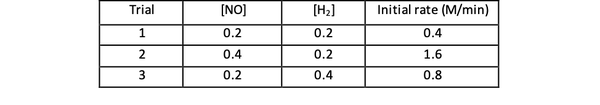
•••Prirejeno iz https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
Pri poskusih 1 in 3 se koncentracija NO ohranja konstantna, medtem ko koncentracija H2 se podvoji. Posledično se je podvojila tudi začetna hitrost reakcije (pomislite na to kot 21), tako da lahko zaključite y = 1. Pri poskusih 1 in 2 se koncentracija NO podvoji, medtem ko koncentracija H2 ostaja stalna. Rezultat te spremembe je, da se je začetna stopnja povečala za štirikrat (pomislite na to kot 22). Zato lahko zaključite x = 2.
Zakon o stopnji za to reakcijo je torej:
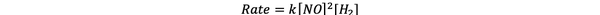
•••Prirejeno iz https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
In reakcija je prvo naročilo v H2 in drugi red v ŠT.

