Кинетика - это раздел физической химии, изучающий скорость химических реакций. Напротив, термодинамика говорит нам, какое направление реакции предпочтительнее, не раскрывая скорости ее реакции. Некоторые реакции могут быть термодинамически благоприятными, но кинетически неблагоприятными.
Например, при преобразовании алмаза в графит свободная энергия графита ниже, чем у алмаза, поэтому преобразование является термодинамически благоприятным. Однако существует большой барьер активации для алмаза, который может разрушить и преобразовать все связи в лучшую сторону. стабильная конфигурация графита, поэтому эта реакция кинетически невыгодна и фактически не произойдет.
Скорость реакции
В скорость реакции - это мера того, как быстро образуются продукты и расходуются реагенты, поэтому вы можете определить его, измерив изменение концентрации продуктов или реагентов за период времени. Рассмотрим общую химическую реакцию:
aA + bB> cC + dD
Скорость реакции можно записать как:
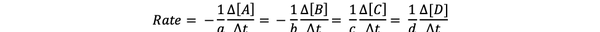
•••Изменено из https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
Например, скорость реакции на:
2 НЕТ (г) + 2 ч2 (g)> N2(г) + 2 H2O (г)
дан кем-то
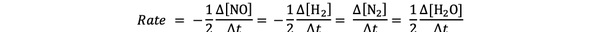
•••Адаптированы из https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
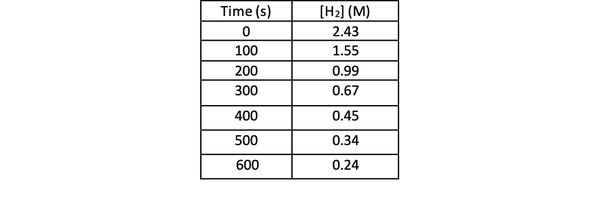
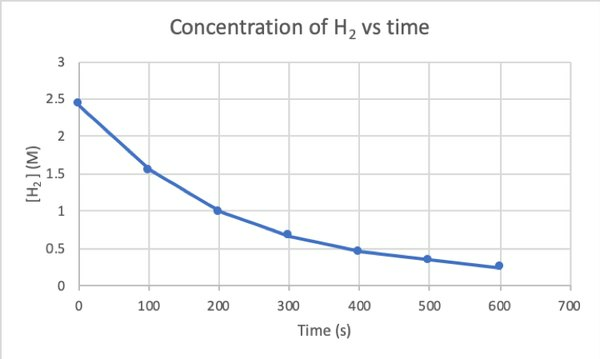
Чтобы определить скорость этой реакции экспериментально, вы можете измерить концентрацию H2 в разное время реакции и нанесите ее на график в зависимости от времени следующим образом:
•••Изменено из https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
•••Изменено из https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
В средняя скорость реакции представляет собой приближение скорости реакции во временном интервале и может быть обозначено как:
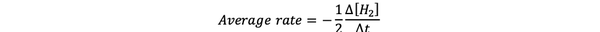
•••Изменено из https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
В мгновенная скорость реакции определяется как скорость реакции в некоторый момент времени. Это дифференциальная ставка, которая может быть выражена следующим образом:
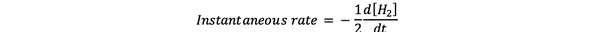
•••Изменено из https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
Где d [H2] / dt - наклон кривой концентрации H2 по сравнению со временем в момент времени t.
В начальная скорость реакции - мгновенная скорость в начале реакции, когда t = 0. В этом случае Ед. изм для средней, мгновенной и начальной скорости реакции М / с.
Закон о ставке
В большинстве случаев скорость реакции зависит от концентрации различных реагентов в момент времени t. Например, при более высокой концентрации всех реагентов реагенты сталкиваются чаще и приводят к более быстрой реакции. Связь между скоростью реакции ν (t) и концентрациями определяется как тарифный закон. А закон скорости общей химической реакции aA + bB> cC + dD таков:
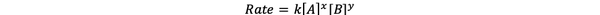
•••Изменено из https://chem.libretexts.org/Bookshelves/Ancillary_Materials/Laboratory_Experiments/Wet_Lab_Experiments/General_Chemistry_Labs/Online_Chemistry_Lab_Manual/Chem_12_Experiments/01%3A_Chemical_Kinetics_-_The_Method_of_Initial_Rates_(Experiment)
Где k - константа скорости, а мощность x и y - заказывать реакции по отношению к реагентам А и В. Закон скорости должен быть определен экспериментально и не может быть выведен только из стехиометрии сбалансированной химической реакции.
Метод начальных ставок
Закон скорости может быть определен метод начальных ставок. В этом методе эксперимент проводится несколько раз, изменяя только концентрацию одного реагента для каждого цикла, сохраняя при этом другие переменные постоянными. Скорость реакции измеряется для каждого запуска, чтобы определить порядок каждого реагента в законе скорости.
Например, рассмотрим следующие данные начальной скорости реакции:
2 НЕТ (г) + 2 ч2 (g)> N2(г) + 2 H2O (г)
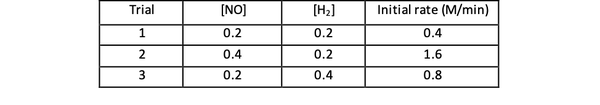
•••Адаптированы из https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
Для испытаний 1 и 3 концентрация NO поддерживается постоянной, в то время как концентрация H2 удваивается. В результате начальная скорость реакции также удвоилась (представьте, что это 21), поэтому можно сделать вывод, что y = 1. Для испытаний 1 и 2 концентрация NO удваивается, в то время как концентрация H2 остается постоянным. В результате этого изменения начальная ставка увеличилась в четыре раза (представьте себе это как 22). Таким образом, можно сделать вывод, что x = 2.
Таким образом, закон скорости этой реакции:
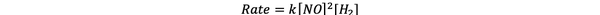
•••Адаптированы из https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
И реакция первый заказ в H2 а также второго порядка в №
