O formulă chimică este o notație standard simplificată pentru explicarea unei reacții chimice utilizate în experimente. Ele pot părea complicate, dar când înveți cum să le citești, devin destul de auto-explicative.
Uitați-vă la reacția chimică pe care încercați să o descompuneți ca o ecuație. Căutați cuvinte cheie, în special componentele chimice implicate. De exemplu, metanul (CH4) este ars, ceea ce înseamnă întotdeauna că se face în oxigen (O2). Aceasta produce atât dioxid de carbon (CO2), cât și vapori de apă (H2O). Rețineți locația cuvântului „Randamente”, deoarece acest lucru este important.
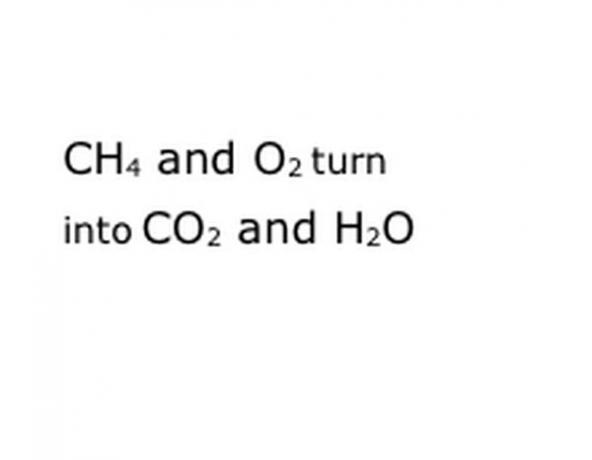
Scrieți componentele chimice ale reacției în formatul de notație standard. În exemplul nostru, acesta va fi CH4, O2, CO2 și H2O. În chimie, a „obține” înseamnă că orice este înainte se transformă în orice urmează, deci asigurați-vă că „randamentul” este aproximativ la mijloc. Această expresie va reprezenta reacția chimică reală, în acest caz arderea. Deci, orice veți arde trebuie să fie înaintea ei și orice rezultat al reacției trebuie să fie după.
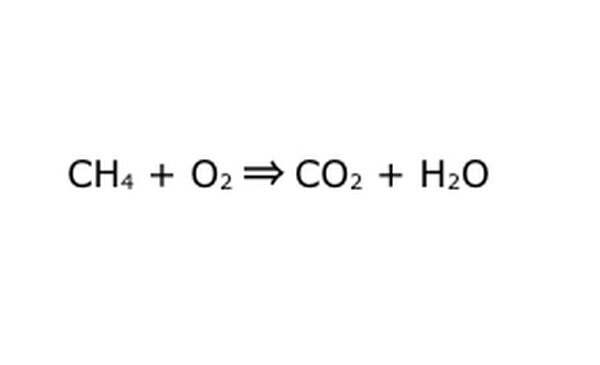
Rescrieți ecuația ca proces matematic. Înlocuiți „randament” sau „se transformă în” cu o săgeată și trageți semne plus între componentele chimice. Pentru a simplifica lucrurile, gândiți-vă la fiecare componentă chimică ca la o moleculă individuală. Poate ajuta la extragerea moleculelor pe o bucată de hârtie. Asigurați-vă că toate moleculele care intră sunt reprezentate ieșind. Dacă lipsește ceva din produsul final, îl puteți adăuga într-un mod care are sens - verificați orice în comparație cu ceea ce știți despre legătura covalentă. Deoarece majoritatea experimentelor se fac în atmosfera obișnuită, puteți adăuga O2, dacă este necesar, la reacțiile de ardere. Dacă ecuația este reversibilă, asigurați-vă că are o săgeată dublă pentru a o reprezenta.
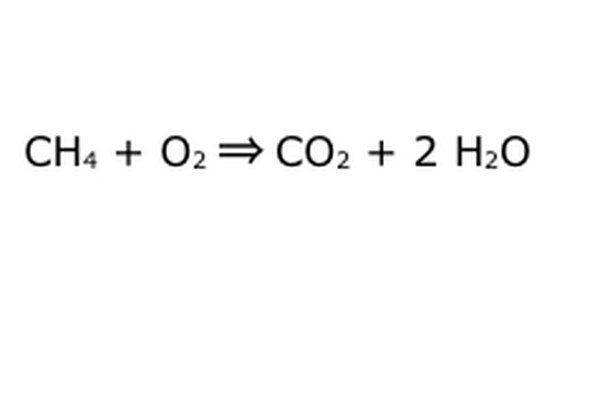
Echilibrează-ți ecuația. Aici intră în joc Legea conservării: gândiți-vă la săgeată, la reacția noastră, ca la o mașină în care ați aruncat toate componentele din stânga. Mașina nu va produce și nu va adăuga nimic din ce nu ați introdus și, prin urmare, va scuipa doar aceeași cantitate de lucruri pe care le-ați introdus. În acest moment precis, avem două molecule de hidrogen în exces care plutesc în jur, pentru că puneți „4”. Singurul loc în care poate merge în această mașină este unul dintre produse, așa că va trebui să intre în moleculele de apă. Scrieți un „2” în fața H2O pentru a indica faptul că pentru fiecare CH4 pe care îl introduceți, veți primi doi H2O înapoi.

Rețineți că există încă o mică problemă cu ecuația noastră: nu intră suficient oxigen. Există patru atomi de oxigen care ies, dar doar doi intră, astfel încât totul este încă dezechilibrat. Scrieți un "2" în fața O2 pentru a reprezenta că trebuie să puneți doi O2 pentru a obține suficient din reacție.
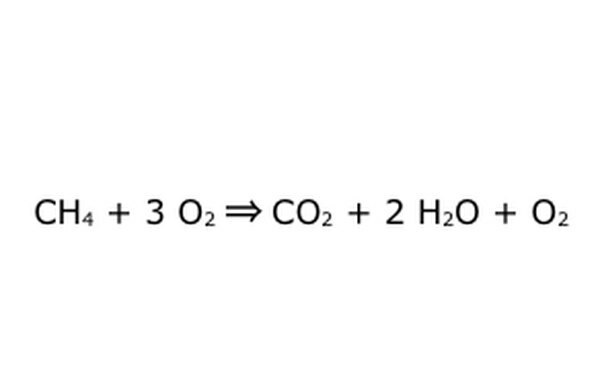
Rețineți că este posibil să faceți un astfel de proces „într-un exces de oxigen”. Ceea ce înseamnă acest lucru este că ecuația introduce mai mult oxigen decât este necesar și primește mai mult înapoi. Pentru exemplu, rețineți că există un O2 suplimentar care intră, deci există un extra care iese. Doar asigurați-vă că Legea Conservării este respectată în orice moment. Orice lucru care intră trebuie să iasă.
sfaturi
În general, substanțele chimice din aceste tipuri de ecuații sunt măsurate în moli. Un mol este o unitate care reprezintă 6,0221415 10 ^ (23) molecule. Deoarece acesta este un număr mult prea mare pentru a fi înțeles, este mai ușor să gândim în termeni de molecule unice atunci când se echilibrează. Fiți conștienți de acest lucru atunci când începeți.
