Wzór chemiczny to uproszczona, standardowa notacja wyjaśniająca reakcję chemiczną stosowaną w eksperymentach. Mogą wyglądać na skomplikowane, ale kiedy nauczysz się je czytać, stają się dość oczywiste.
Spójrz na reakcję chemiczną, którą próbujesz rozłożyć jako równanie. Poszukaj słów kluczowych, a konkretnie zaangażowanych składników chemicznych. Na przykład spalany jest metan (CH4), co zawsze oznacza, że odbywa się to w tlenie (O2). Daje to zarówno dwutlenek węgla (CO2), jak i parę wodną (H2O). Zwróć uwagę na lokalizację słowa „Plony”, ponieważ jest to ważne.
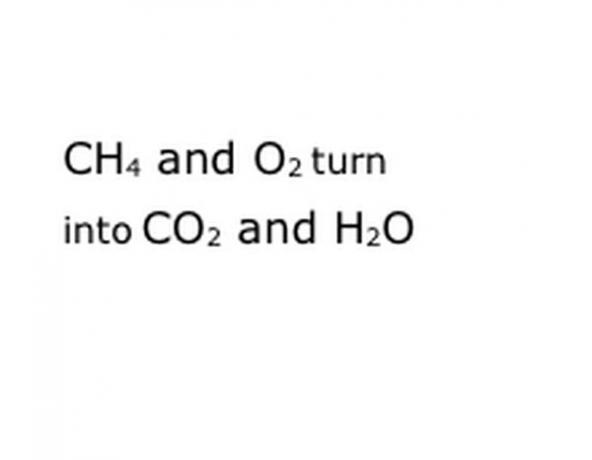
Zapisz składniki chemiczne reakcji w standardowym formacie notacji. W naszym przykładzie będą to CH4, O2, CO2 i H2O. W chemii „wydajność” oznacza, że to, co jest przed, zamienia się w to, co nastąpi później, więc upewnij się, że „wydajność” jest mniej więcej pośrodku. Ta fraza będzie reprezentować rzeczywistą reakcję chemiczną, w tym przypadku spalanie. Więc wszystko, co spalisz, musi być przed, a wszystko, co zaowocuje reakcja, musi nastąpić po.
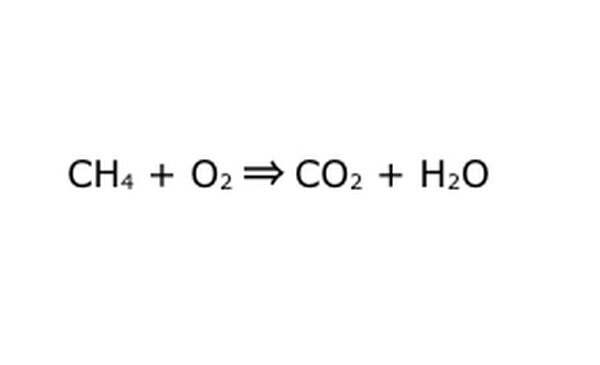
Przepisz równanie jako proces matematyczny. Zamień "plon" lub "zamienia się" na strzałkę i narysuj znaki plus między składnikami chemicznymi. Aby uprościć sprawę, pomyśl o każdym składniku chemicznym jako o osobnej cząsteczce. Pomocne może być wyciągnięcie molekuł na skrawku papieru. Upewnij się, że wszystkie cząsteczki, które wchodzą, są reprezentowane jako wychodzące. Jeśli czegoś brakuje w produkcie końcowym, możesz dodać to w sensowny sposób – porównaj wszystko z tym, co wiesz o wiązaniach kowalencyjnych. Ponieważ większość eksperymentów odbywa się w zwykłej atmosferze, w razie potrzeby można dodać O2 do reakcji spalania. Jeśli równanie jest odwracalne, upewnij się, że ma podwójną strzałkę, która to reprezentuje.
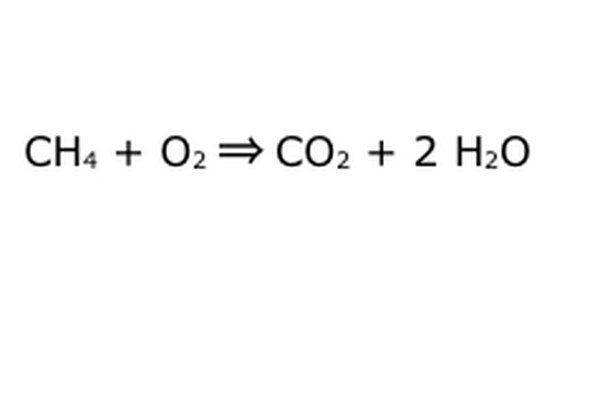
Zrównoważ swoje równanie. W tym miejscu do gry wchodzi prawo zachowania: pomyśl o strzałce, naszej reakcji, jak o maszynie, do której wrzuciłeś wszystkie komponenty po lewej stronie. Maszyna nie zrobi ani nie doda niczego, czego nie włożyłeś, i dlatego wypluje tylko taką samą ilość rzeczy, które włożysz. W tym dokładnie momencie mamy dwie nadmiarowe cząsteczki wodoru unoszące się wokół, ponieważ wstawiasz „4”. Jedyne miejsce, w którym może się znaleźć w tej maszynie, to jeden z produktów, więc będzie musiał wejść do cząsteczek wody. Napisz „2” przed H2O, aby wskazać, że za każdy wprowadzony CH4 otrzymasz z powrotem dwie H2O.

Zauważ, że wciąż jest mały problem z naszym równaniem: nie ma wystarczającej ilości tlenu. Wychodzą cztery atomy tlenu, ale wchodzą tylko dwa, więc całość jest wciąż niezrównoważona. Napisz „2” przed O2, aby wskazać, że musisz włożyć dwa O2, aby uzyskać wystarczającą ilość reakcji.
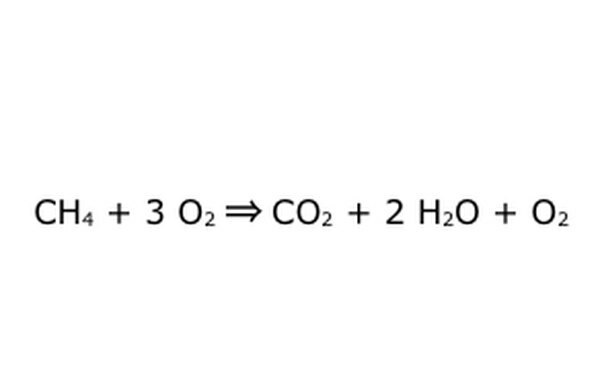
Zauważ, że możliwe jest wykonanie takiego procesu „w nadmiarze tlenu”. Oznacza to, że równanie dostarcza więcej tlenu niż potrzeba i otrzymuje więcej. Na przykład zauważ, że wchodzi dodatkowy O2, więc jest dodatkowe wyjście. Tylko upewnij się, że Prawo Zachowania jest zawsze przestrzegane. Wszystko, co wchodzi, musi wyjść.
Wskazówki
Ogólnie rzecz biorąc, chemikalia w tego typu równaniach są mierzone w molach. Mol jest jednostką reprezentującą 6,0221415 10^(23) cząsteczek. Ponieważ jest to liczba zbyt duża, aby ją pojąć, łatwiej jest myśleć w kategoriach pojedynczych cząsteczek podczas równoważenia. Bądź tego świadomy, kiedy zaczynasz.
