Ogniwa elektrochemiczne informują o tym, jak baterie ładują obwody i jak zasilane są urządzenia elektroniczne, takie jak telefony komórkowe i zegarki cyfrowe. Patrząc na chemię komórek E, potencjał komórek elektrochemicznych, znajdziesz reakcje chemiczne napędzające je, które wysyłają prąd elektryczny przez ich obwody. Potencjałmikomórki może powiedzieć, jak zachodzą te reakcje.
Obliczanie komórki E
•••Syed Hussain Ather
Wskazówki
Manipuluj reakcjami połówkowymi, zmieniając je, mnożąc je przez wartości całkowite, odwracając znak potencjału elektrochemicznego i mnożąc potencjał. Upewnij się, że przestrzegasz zasad redukcji i utleniania. Zsumuj potencjały elektrochemiczne dla każdej połówkowej reakcji w ogniwie, aby uzyskać całkowity potencjał elektrochemiczny lub elektromotoryczny ogniwa.
Aby obliczyćpotencjał elektromotoryczny, znany również jako potencjał siły elektromotorycznej (EMF), zgalwaniczny, lub voltaic, używając formuły E Cell podczas obliczania E Cell:
- Podziel równanie na połówki reakcji, jeśli jeszcze nie jest.
- Określ, które równanie (jeśli istnieje) należy odwrócić lub pomnożyć przez liczbę całkowitą. Możesz to ustalić, najpierw ustalając, które połówki reakcji najprawdopodobniej wystąpią w reakcji spontanicznej. Im mniejsza wielkość potencjału elektrochemicznego reakcji, tym większe prawdopodobieństwo jej wystąpienia. Jednak ogólny potencjał reakcji musi pozostać dodatni.
- Na przykład połowa reakcji z potencjałem elektrochemicznym-0,5 Vjest bardziej prawdopodobne niż ten z potencjałem with1 V.
- Po ustaleniu, które reakcje są najbardziej prawdopodobne, będą one stanowić podstawę utleniania i redukcji stosowanych w reakcji elektrochemicznej.
- Odwróć równania i pomnóż obie strony równań przez liczby całkowite, aż zsumują się do ogólnej reakcji elektrochemicznej, a elementy po obu stronach zniosą się. W przypadku każdego odwróconego równania odwróć znak. Dla dowolnego równania, które pomnożysz przez liczbę całkowitą, pomnóż potencjał przez tę samą liczbę całkowitą.
- Zsumuj potencjały elektrochemiczne dla każdej reakcji, biorąc pod uwagę znaki ujemne.
Możesz zapamiętać anodę z równaniem komórki E z mnemonikiem „Red Cat An Ox”, który mówi ciczerwonyakcja następuje w atkotHode inaodawółidentyfikuje.
Oblicz potencjały elektrod następujących półogniw
Na przykład możemy mieć ogniwo galwaniczne ze źródłem prądu stałego. Wykorzystuje następujące równania w klasycznej baterii alkalicznej AA z odpowiednimi potencjałami elektrochemicznymi w połowie reakcji. Obliczanie e-komórki jest łatwe za pomocąmirównanie ogniwa dla katody i anody.
- MnO2(s) + H2O + e− → MnOOH(y) + OH-(aq); mio= +0,382 V
- Zn (s) + 2 OH -(aq) → Zn (OH)2(s) + 2e-; mio = +1.221 V
W tym przykładzie pierwsze równanie opisuje wodęH2Ozredukowany przez utratę protonu (H+) kształtowaćO- podczas gdy tlenek magnezuMnO2jest utleniany poprzez uzyskanie protonu (H+) z wytworzeniem tlenku manganu-wodorotlenkuMnOOH.Drugie równanie opisuje cynkZnutlenianie się dwoma jonami wodorotlenowymiO - z wytworzeniem wodorotlenku cynku Zn (OH)2 uwalniając dwa elektrony.
Aby utworzyć ogólne równanie elektrochemiczne, które chcemy, najpierw zauważ, że równanie (1) jest bardziej prawdopodobne niż równanie (2), ponieważ ma mniejszą wielkość potencjału elektrochemicznego. To równanie to redukcja wodyH2Otworzyć wodorotlenekO-i utlenianie tlenku magnezuMnO2. Oznacza to, że odpowiedni proces drugiego równania musi utleniać wodorotlenekO-aby przywrócić go z powrotem do wodyH2O .Aby to osiągnąć, musisz zredukować wodorotlenek cynkuZn (OH)2wróć do cynkuZn.
Oznacza to, że drugie równanie musi zostać odwrócone. Jeśli go odwrócisz i zmienisz znak potencjału elektrochemicznego, uzyskaszZn (OH)2(s) + 2e- → Zn (s) + 2 OH -(aq) o odpowiednim potencjale elektrochemicznymmio = -1,221 V.
Przed zsumowaniem obu równań należy pomnożyć każdy reagent i produkt pierwszego równania przez liczba całkowita 2, aby upewnić się, że 2 elektrony z drugiej reakcji zrównoważą pojedynczy elektron z pierwszej jeden. Oznacza to, że nasze pierwsze równanie to 2MnO2(s) + 2 godz2O + 2e− → 2MnOOH(y) + 2OH-(aq)o potencjale elektrochemicznymmio= +0,764 V
Dodaj te dwa równania razem i dwa potencjały elektrochemiczne razem, aby uzyskać połączoną reakcję: 2MnO2(s) + 2 godz2O + Zn (OH)2(y) → Zn (s) + MnOOH(y)z potencjałem elektrochemicznym-0,457 V. Zauważ, że 2 jony wodorotlenkowe i 2 elektrony po obu stronach znoszą się podczas tworzenia wzoru ECell.
Chemia komórek E
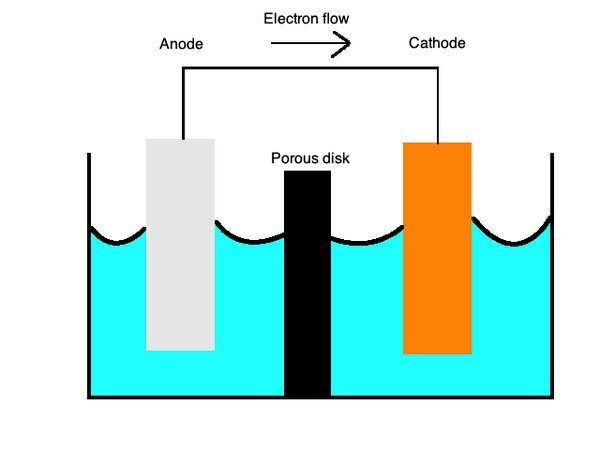
Równania te opisują procesy utleniania i redukcji za pomocą półporowatej membrany oddzielonej mostkiem solnym.Most solnyjest wykonany z materiału takiego jak siarczan potasu, który służy jako obojętny elektrolit, który umożliwia dyfuzję jonów po jego powierzchni.
Nakatody, utlenianie lub utrata elektronów, występuje, a naanody, następuje redukcja lub wzmocnienie elektronów. Możesz to zapamiętać dzięki mnemonicznemu słowu „OILRIG”. Mówi ci, że "Oksydacja to strata" ("OIL") i "Redukcja to zysk" ("RIG"). Elektrolit to ciecz, która umożliwia przepływ jonów przez obie te części ogniwa.
Pamiętaj, aby nadać priorytet równaniom i reakcjom, które są bardziej prawdopodobne, ponieważ mają mniejszy potencjał elektrochemiczny. Reakcje te stanowią podstawę ogniw galwanicznych i wszystkich ich zastosowań, a podobne reakcje mogą zachodzić w kontekście biologicznym. Błony komórkowe wytwarzają transbłonowy potencjał elektryczny, gdy jony przemieszczają się przez błonę i przez elektromotoryczne potencjały chemiczne.
Na przykład konwersja zredukowanego dinukleotydu nikotynamidoadeninowego (NADH) w obecności protonów (H+) i tlen cząsteczkowy (O2) wytwarza jego utleniony odpowiednik (NAD+) wzdłuż wody (H2O) jako część łańcucha transportu elektronów. Dzieje się tak z protonemgradient elektrochemicznyspowodowane potencjałem umożliwienia fosforylacji oksydacyjnej w mitochondriach i wytwarzania energii.
Równanie Nernsta
Równanie Nernstapozwala obliczyć potencjał elektrochemiczny na podstawie stężeń produktów i reagentów w równowadze z potencjałem komórki w woltachmikomórka tak jak
E_{komórka}=E_{komórka}^--\frac{RT}{zF}\ln{Q}
w którymmi-komórka jest potencjałem reakcji połówkowej redukcji,Rjest uniwersalną stałą gazową (8,31 J x K−1 mol−1), Tjest temperatura w Kelwinach,zto liczba elektronów przeniesionych w reakcji, orazQjest ilorazem reakcji całkowitej reakcji.
Iloraz reakcjiQto stosunek obejmujący stężenia produktów i reagentów. Dla hipotetycznej reakcji:aA + bB ⇌ cC + dDz reagentamiZAib, produktydoirei odpowiadające im wartości całkowiteza, b, do, ireiloraz reakcjiQbyłobyQ = [C]do[RE]re / [A]za[B]bz każdą wartością w nawiasie jako stężeniem, zwykle inmol/L. Na przykład reakcja mierzy ten stosunek produktów do reagentów.
Potencjał ogniwa elektrolitycznego
Ogniwa elektrolityczneróżnią się od ogniw galwanicznych tym, że wykorzystują zewnętrzne źródło baterii, a nie naturalny potencjał elektrochemiczny do przesyłania energii elektrycznej przez obwód. może używać elektrod wewnątrz elektrolitu w niespontanicznej reakcji.
Ogniwa te wykorzystują również wodny lub stopiony elektrolit w przeciwieństwie do mostka solnego ogniw galwanicznych. Elektrody pasują do bieguna dodatniego, anody i bieguna ujemnego, katody akumulatora. Podczas gdy ogniwa galwaniczne mają dodatnie wartości EMF, ogniwa elektrolityczne mają ujemne, co oznacza, że dla ogniwa galwaniczne, reakcje zachodzą samoistnie, podczas gdy ogniwa elektrolityczne wymagają zewnętrznego napięcia źródło.
Podobnie jak w przypadku ogniw galwanicznych, można manipulować, odwracać, mnożyć i dodawać równania połówkowe reakcji, aby uzyskać ogólne równanie ogniwa elektrolitycznego.
