Probabilmente hai riscontrato che le batterie si scaricano, il che è una seccatura se stai cercando di usarle in dispositivi elettronici. La chimica delle celle delle batterie può dirti le proprietà di come funzionano, incluso il modo in cui si scaricano.
Chimica cellulare delle batterie
•••Syed Hussain Ather
Quando la reazione elettrochimica di una batteria esaurisce i materiali, la batteria si scarica. Questo accade generalmente dopo un lungo periodo di utilizzo della batteria.
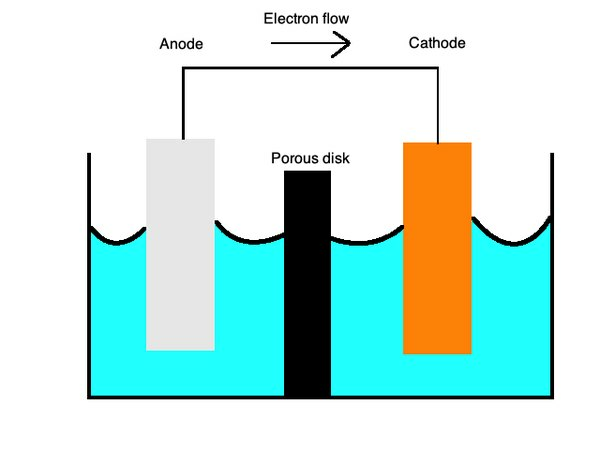
Le batterie generalmente utilizzano celle primarie, un tipo dicella galvanicache utilizza due metalli diversi in un elettrolita liquido per consentire il trasferimento di carica tra di loro. Le cariche positive fluiscono dacatodo, costruito con cationi o ioni caricati positivamente come il rame, alanodo, con anioni o ioni caricati negativamente come lo zinco.
Suggerimenti
Le batterie si scaricano a causa dell'essiccazione delle sostanze chimiche dell'elettrolita all'interno della batteria. Nel caso delle batterie alcaline, questo è quando tutto il biossido di manganese è stato convertito. In questa fase la batteria è scarica.
Per ricordare questa relazione, puoi ricordare la parola "OILRIG". Questo ti dice chel'ossidazione è perdita("OLIO") ela riduzione è guadagno(“RIG”) di elettroni. Ilmnemonico per anodi e catodos è "ANOX REDCAT" per ricordare che "ANode" viene utilizzato con "OXidation" e "REDuction" avviene al "CAThode".
Le celle primarie possono anche funzionare con singole semicelle di metalli diversi in una soluzione ionica collegate da un ponte salino o da una membrana porosa. Queste celle forniscono alle batterie una miriade di usi.
Batterie alcaline, che sfruttano nello specifico la reazione tra un anodo di zinco e un catodo di magnesio, sono utilizzati per torce elettriche, dispositivi elettronici portatili e telecomandi. Altri esempi di elementi di batteria popolari includono litio, mercurio, silicio, ossido d'argento, acido cromico e carbonio.
I progetti di ingegneria possono sfruttare il modo in cui le batterie si scaricano per risparmiare e riutilizzare l'energia. Le batterie domestiche a basso costo generalmente utilizzano celle zinco-carbone progettate in modo tale che, se lo zinco subiscecorrosione galvanica, un processo in cui un metallo si corrode preferenzialmente, la batteria può produrre elettricità come parte di un circuito elettronico chiuso.
A che temperatura esplodono le batterie? La chimica delle celle delle batterie agli ioni di litio significa che queste batterie iniziano reazioni chimiche che provocano la loro esplosione a circa 1.000 °C. Il materiale di rame al loro interno si scioglie causando la rottura dei nuclei interni.
Storia della cella chimica
Nel 1836 il chimico britannico John Frederic Daniell costruì ilDaniell cellularein cui usava due elettroliti, invece di uno solo, per far consumare l'idrogeno prodotto da uno dall'altro. Usò solfato di zinco al posto dell'acido solforico, pratica comune delle batterie dell'epoca.
Prima di allora, gli scienziati usavano celle voltaiche, un tipo di cella chimica che utilizza una reazione spontanea, che perdeva potenza a velocità elevate. Daniell ha utilizzato una barriera tra le piastre di rame e zinco per evitare che l'idrogeno in eccesso gorgogliasse e impedisse alla batteria di consumarsi rapidamente. Il suo lavoro porterebbe a innovazioni nella telegrafia e nell'elettrometallurgia, il metodo di utilizzo dell'energia elettrica per produrre metalli.
Come si scaricano le batterie ricaricabili?
Cellule secondarie, invece, sono ricaricabili. La batteria ricaricabile, chiamata anche accumulatore, cella secondaria o accumulatore, immagazzina la carica nel tempo poiché il catodo e l'anodo sono collegati in un circuito tra loro.
Durante la carica, il metallo attivo positivo come l'idrossido di ossido di nichel si ossida, creando elettroni e perdendoli, mentre il materiale negativo come il cadmio si riduce, catturando elettroni e guadagnando loro. La batteria utilizza cicli di carica-scarica utilizzando una varietà di fonti tra cui l'elettricità a corrente alternata come fonte di tensione esterna.
Le batterie ricaricabili possono ancora scaricarsi dopo un uso ripetuto perché i materiali coinvolti nella reazione perdono la capacità di caricarsi e ricaricarsi. Man mano che questi sistemi di batterie si esauriscono, ci sono diversi modi in cui le batterie si scaricano.
Poiché le batterie vengono utilizzate di routine, alcune di esse, come le batterie al piombo acido, potrebbero perdere la capacità di ricaricarsi. Il litio delle batterie agli ioni di litio può diventare metallo di litio reattivo che non può rientrare nel ciclo di carica-scarica. Le batterie con elettroliti liquidi possono diminuire la loro umidità a causa dell'evaporazione o del sovraccarico.
Applicazioni delle batterie ricaricabili
Queste batterie sono generalmente utilizzate negli avviatori di automobili, sedie a rotelle, biciclette elettriche, utensili elettrici e centrali elettriche di accumulo di batterie. Scienziati e ingegneri hanno studiato il loro uso nelle batterie ibride a combustione interna e nei veicoli elettrici per diventare più efficaci nel loro consumo di energia e durare più a lungo.
La batteria ricaricabile al piombo rompe le molecole d'acqua (H2oh) in soluzione acquosa di idrogeno (H+) e ioni ossido (oh2-) che produce energia elettrica dal legame rotto man mano che l'acqua perde la sua carica. Quando la soluzione acquosa di idrogeno reagisce con questi ioni ossido, i forti legami O-H vengono utilizzati per alimentare la batteria.
Fisica delle reazioni della batteria
Questa energia chimica alimenta una reazione redox che converte i reagenti ad alta energia in prodotti a bassa energia. La differenza tra i reagenti e i prodotti consente la reazione e forma un circuito elettrico quando la batteria è collegata convertendo l'energia chimica in energia elettrica.
In una cella galvanica, i reagenti, come lo zinco metallico, hanno un'elevata energia libera che fa sì che la reazione avvenga spontaneamente senza forze esterne.
I metalli utilizzati nell'anodo e nel catodo hanno energie coesive reticolari che possono guidare la reazione chimica. L'energia coesiva reticolare è l'energia necessaria per separare gli atomi che compongono il metallo l'uno dall'altro. Zinco metallico, cadmio, litio e sodio sono spesso utilizzati perché hanno elevate energie di ionizzazione, l'energia minima richiesta per rimuovere gli elettroni da un elemento.
Le celle galvaniche guidate da ioni dello stesso metallo possono utilizzare differenze di energia libera per far sì che l'energia libera di Gibbs guidi la reazione. IlEnergia libera di Gibbsè un'altra forma di energia utilizzata per calcolare la quantità di lavoro utilizzata da un processo termodinamico.
In questo caso, la variazione dell'energia libera di Gibbs standardGo guida la tensione, o forza elettromotriceEoin volt, secondo l'equazione
E^{\text{o}}=\frac{-\Delta_rG^{\text{o}}}{v_eF}
in qualeveè il numero di elettroni trasferiti durante la reazione e F è la costante di Faraday (F = 96485,33 C mol−1).
IlΔrGo indica che l'equazione utilizza la variazione dell'energia libera di Gibbs (ΔrGo =Gfinale - Giniziale).L'entropia aumenta man mano che la reazione utilizza l'energia libera disponibile. Nella cella di Daniell, la differenza di energia coesiva reticolare tra zinco e rame rappresenta la maggior parte della differenza di energia libera di Gibbs quando si verifica la reazione.ΔrGo= -213 kJ/mol, che è la differenza tra l'energia libera di Gibbs dei prodotti e quella dei reagenti.
Tensione di una cella galvanica
Se si separa la reazione elettrochimica di una cella galvanica nelle semireazioni di ossidazione e riduzione processi, è possibile sommare le forze elettromotrici corrispondenti per ottenere la differenza di tensione totale utilizzata nel cellula.
Ad esempio, una tipica cella galvanica può utilizzare CuSO4 e ZnSO4 con semireazioni potenziali standard come:Cu2+ + 2 e− Cucon un corrispondente potenziale elettromotoreEo = +0,34 VeZn2+ + 2 e− Zncon potenzialeEo = -0,76 V.
Per la reazione complessiva,Cu2+ + Zn ⇌ Cu + Zn2+ , puoi "capovolgere" l'equazione della semireazione per lo zinco mentre inverti il segno della forza elettromotrice per ottenereZn ⇌ Zn2+ + 2 e− conEo = 0,76 V.Il potenziale di reazione complessivo, la somma delle forze elettromotrici, è quindi+0,34 V − (−0,76 V) = 1,10 V.
