Sel elektrokimia memberi tahu Anda tentang bagaimana baterai mengisi sirkuit dan bagaimana perangkat elektronik seperti ponsel dan jam tangan digital diberi daya. Melihat ke dalam kimia sel E, potensi sel elektrokimia, Anda akan menemukan reaksi kimia yang menggerakkan mereka yang mengirimkan arus listrik melalui sirkuit mereka. PotensiEsel dapat memberitahu Anda bagaimana reaksi ini terjadi.
Menghitung Sel E
•••Syed Hussain Ather
Tips
Manipulasi setengah reaksi dengan menata ulang, mengalikannya dengan nilai bilangan bulat, membalik tanda potensial elektrokimia, dan mengalikan potensial. Pastikan Anda mengikuti aturan reduksi dan oksidasi. Jumlahkan potensial elektrokimia untuk setiap setengah reaksi dalam sel untuk mendapatkan total potensial elektrokimia atau elektromotif sel.
Untuk menghitungpotensial gerak listrik, juga dikenal sebagai potensial gaya gerak listrik (EMF), darigalvanik, atau sel volta, menggunakan rumus Sel E saat menghitung Sel E:
- Bagi persamaan menjadi setengah reaksi jika belum.
- Tentukan persamaan (s), jika ada, yang harus dibalik atau dikalikan dengan bilangan bulat. Anda dapat menentukan ini dengan terlebih dahulu mencari tahu setengah reaksi mana yang paling mungkin terjadi dalam reaksi spontan. Semakin kecil besarnya potensial elektrokimia suatu reaksi, semakin besar kemungkinan terjadinya. Namun, potensi reaksi keseluruhan harus tetap positif.
- Misalnya, setengah reaksi dengan potensial elektrokimia-.5 Vlebih mungkin terjadi daripada yang potensial1 V
- Ketika Anda telah menentukan reaksi mana yang paling mungkin terjadi, reaksi tersebut akan menjadi dasar oksidasi dan reduksi yang digunakan dalam reaksi elektrokimia.
- Balikkan persamaan dan kalikan kedua ruas persamaan dengan bilangan bulat hingga jumlah keseluruhan reaksi elektrokimia dan unsur-unsur di kedua sisi saling meniadakan. Untuk persamaan apa pun yang Anda balikkan, balikkan tandanya. Untuk persamaan apa pun yang Anda kalikan dengan bilangan bulat, kalikan potensial dengan bilangan bulat yang sama.
- Jumlahkan potensial elektrokimia untuk setiap reaksi sambil memperhatikan tanda-tanda negatif.
Anda dapat mengingat anoda katoda persamaan sel E dengan mnemonik "Kucing Merah An Ox" yang memberitahu Andamerahuksi terjadi padakucingho dansebuahsyair pujianlembumengidolakan.
Hitung Potensial Elektroda Setengah Sel Berikut Following
Sebagai contoh, kita mungkin memiliki sel galvanik dengan sumber daya listrik DC. Ini menggunakan persamaan berikut dalam baterai alkaline AA klasik dengan potensial elektrokimia setengah reaksi yang sesuai. Menghitung sel e mudah menggunakanEpersamaan sel untuk katoda dan anoda.
- MnO2(s) + H2O + e− → MnOOH(s) + OH-(aq); EHai= +0,382 V
- Zn(s)+ 2 OH -(aq) → Zn (OH)2(s) + 2e-; EHai = +1.221 V
Dalam contoh ini, persamaan pertama menggambarkan airH2HAIdireduksi dengan kehilangan proton (H+) untuk membentukOH- sedangkan magnesium oksidaMnO2teroksidasi dengan memperoleh proton (H+) untuk membentuk mangan oksida-hidroksidaMnOOH.Persamaan kedua menjelaskan sengZnmenjadi teroksidasi dengan dua ion hidroksidaOH - untuk membentuk seng hidroksida Zn (OH)2 sambil melepaskan dua elektron.
Untuk membentuk persamaan elektrokimia keseluruhan yang kita inginkan, pertama-tama Anda perhatikan bahwa persamaan (1) lebih mungkin terjadi daripada persamaan (2) karena memiliki magnitudo potensial elektrokimia yang lebih rendah. Persamaan ini adalah pengurangan airH2HAImembentuk hidroksidaOH-dan oksidasi magnesium oksidaMnO2. Ini berarti proses yang sesuai dari persamaan kedua harus mengoksidasi hidroksidaOH-untuk mengembalikannya ke airH2O .Untuk mencapai ini, Anda harus mengurangi seng hidroksidaZn (OH)2kembali ke sengZn.
Ini berarti persamaan kedua harus dibalik. Jika Anda membaliknya dan mengubah tanda potensial elektrokimia, Anda memperolehZn (OH)2(s) + 2e- → Zn(s)+ 2 OH -(aq) dengan potensial elektrokimia yang sesuaiEHai = -1.221 V
Sebelum menjumlahkan kedua persamaan, Anda harus mengalikan setiap reaktan dan produk dari persamaan pertama dengan bilangan bulat 2 untuk memastikan 2 elektron dari reaksi kedua menyeimbangkan elektron tunggal dari yang pertama satu. Ini berarti persamaan pertama kita menjadi 2MnO2(s) + 2 H2O + 2e− → 2MnOOH(s) + 2OH-(aq)dengan potensial elektrokimiaEHai= +0,764 V
Tambahkan dua persamaan ini bersama-sama dan dua potensial elektrokimia bersama-sama untuk mendapatkan reaksi gabungan: 2MnO2(s) + 2 H2O + Zn (OH)2(s) → Zn(s) + MnOOH(s)dengan potensial elektrokimia-0,457 V. Perhatikan bahwa 2 ion hidroksida dan 2 elektron di kedua sisi saling hapus saat membuat rumus ECell.
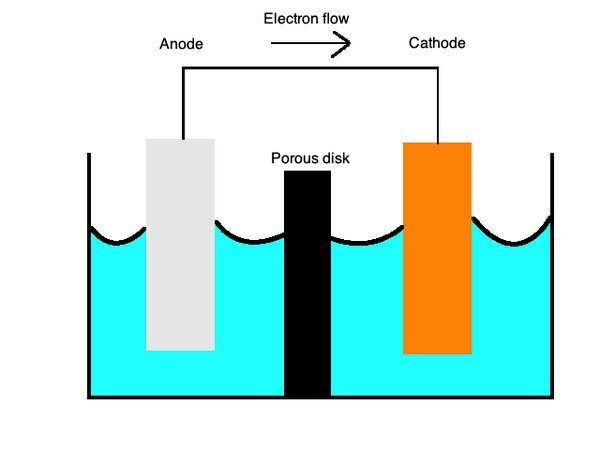
Kimia Sel E
Persamaan ini menggambarkan proses oksidasi dan reduksi dengan membran semi berpori yang dipisahkan oleh jembatan garam. Itujembatan garamterbuat dari bahan seperti kalium sulfat yang berfungsi sebagai n elektrolit inert yang memungkinkan ion berdifusi melintasi permukaannya.
Padakatoda, oksidasi, atau kehilangan elektron, terjadi, dan, padaanoda, reduksi, atau perolehan elektron, terjadi. Anda dapat mengingat ini dengan kata mnemonik "OILRIG." Ini memberitahu Anda bahwa "Oksidasi Adalah Rugi" ("OIL") dan "Reduksi Adalah Keuntungan" ("RIG"). Elektrolit adalah cairan yang memungkinkan ion mengalir melalui kedua bagian sel ini.
Ingatlah untuk memprioritaskan persamaan dan reaksi yang lebih mungkin terjadi karena memiliki besaran potensial elektrokimia yang lebih rendah. Reaksi-reaksi ini membentuk dasar untuk sel galvanik dan semua kegunaannya, dan reaksi serupa dapat terjadi dalam konteks biologis. Membran sel menghasilkan potensial listrik transmembran sebagai ion bergerak melintasi membran dan melalui potensi kimia elektromotive.
Misalnya, konversi nikotinamida adenin dinukleotida tereduksi (NADH) dengan adanya proton (H+) dan molekul oksigen (HAI2) menghasilkan padanan teroksidasinya (NAD+) di samping air (H2HAI) sebagai bagian dari rantai transpor elektron. Ini terjadi dengan protongradien elektrokimiadisebabkan oleh potensi untuk membiarkan fosforilasi oksidatif terjadi di mitokondria dan menghasilkan energi.
Persamaan Nernst
Itupersamaan Nernstmemungkinkan Anda menghitung potensial elektrokimia menggunakan konsentrasi produk dan reaktan pada kesetimbangan dengan potensial sel dalam voltEsel sebagai
E_{sel}=E_{sel}^--\frac{RT}{zF}\ln{Q}
di manaE-sel adalah potensial untuk setengah reaksi reduksi,Radalah konstanta gas universal (8,31 J x K−1 mol−1), Tadalah suhu dalam Kelvin,zadalah jumlah elektron yang ditransfer dalam reaksi, danQadalah hasil bagi reaksi dari reaksi keseluruhan.
Hasil bagi reaksiQadalah rasio yang melibatkan konsentrasi produk dan reaktan. Untuk reaksi hipotetis:aA + bB cC + dDdengan reaktanSEBUAHdanB, produkCdanD, dan nilai bilangan bulat yang sesuaiSebuah, b, c, dand, hasil bagi reaksiQakan menjadiQ = [C]c[D]d / [SEBUAH]Sebuah[B]bdengan masing-masing nilai dalam kurung sebagai konsentrasi, biasanya dalamperempuan jalang. Untuk setiap contoh, reaksi mengukur rasio produk ini terhadap reaktan.
Potensi Sel Elektrolisis
Sel elektrolisisberbeda dari sel galvanik dalam hal mereka menggunakan sumber baterai eksternal, bukan potensi elektrokimia alami, untuk menggerakkan listrik melalui sirkuit. dapat menggunakan elektroda di dalam elektrolit dalam reaksi nonspontan.
Sel-sel ini juga menggunakan elektrolit berair atau cair berbeda dengan jembatan garam sel galvanik. Elektroda cocok dengan terminal positif, anoda, dan terminal negatif, katoda, baterai. Sementara sel galvanik memiliki nilai EMF positif, sel elektrolit memiliki nilai negatif yang berarti, untuk sel galvanik, reaksi terjadi secara spontan sedangkan sel elektrolisis memerlukan tegangan eksternal sumber.
Mirip dengan sel galvanik, Anda dapat memanipulasi, membalik, mengalikan, dan menambahkan persamaan setengah reaksi untuk menghasilkan persamaan sel elektrolitik secara keseluruhan.
