A szén nem fémes elem, C vegyi szimbólummal. Ez az univerzum negyedik leggyakoribb eleme, a Föld kérgében pedig a 15. leggyakoribb elem. Ez az oxigén után a második leggyakoribb elem az emberben. Kémiai összetétele a szén számos egyedi tulajdonságához vezet.
A szén a periódusos rendszer 14. csoportjába tartozik. Atomszáma 6, atomtömege 12.011. A szén oxidációs állapota -4 és +4 között változhat, ahol +4 létezik olyan vegyületekben, mint a metán és a szén-diszulfid, és +2 a szén-monoxid esetében.
A különböző szén-allotrópok fizikai tulajdonságai miatt azok hasznosak az akkumulátorokban, az elektronikában és a nanoanyagokban. A szén is az „elemek királya”, szinte képződik 10 millió vegyület szerves, szervetlen és fémorganikus vegyületeket.
A szén izotópjait széles körben használják a radiokarbon dátumozáshoz (szén-14), a molekulaszerkezethez és az orvosi kutatáshoz (szén-13). Ezenkívül a szénszálak kiváló mechanikai tulajdonságokkal rendelkeznek, és népszerűek az űrhajózásban és az építőiparban.
Szén allotropjai
A szénnek más allotrop formák, különböző molekuláris konfigurációkkal és atomszerkezetekkel. A szén fizikai tulajdonságai az egyes allotrópoknál nagyon változnak. A szén legismertebb allotropjai közé tartozik a grafit, a gyémánt és a fullerének.
A grafit az egyik legpuhább ismert anyag, ceruzákban és szilárd kenőanyagként használják. Ez egyben jó áramvezető, így akkumulátorokban és napelemekben hasznos.
A grafén egyszerűen egy méhsejtes rácsba rendezett grafit egy atomrétege. A grafénrétegben minden szénatom kovalensen kapcsolódik három másik atomhoz, így a negyedik elektron szabadon vándorolhat a síkban, ezért elektromos vezetőképessége.
A gyémánt éppen ellenkezőleg, a legnehezebben előforduló természetes anyag, és a szén egyedülálló tulajdonságainak egyike. A grafit sűrűségének majdnem kétszerese van, és minden szénatom tetraéderesen kapcsolódik négy másikhoz, szabadon áramló elektronok nélkül. Így a gyémánt rossz áramvezető. A gyémánt küllemében is tiszta, ellentétben a grafittal, amely átlátszatlan.
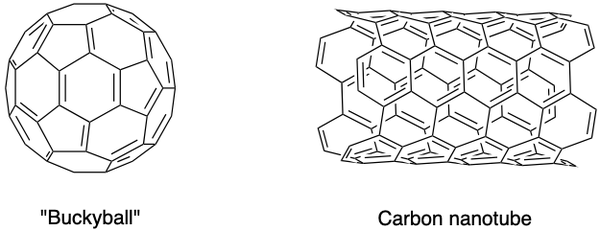
A tudósok szintetizáltak más szén-allotropokat is, például fulleréneket, szén nanohabokat és másokat. Különleges tulajdonságokkal rendelkeznek, és virágzó kutatási területet képeznek nanoanyagok. A fullerének egy üreges szénmolekula csoportja egy zárt ketrecben (buckyball) vagy hengerben (szén nanocsövek).
•••A ChemDraw segítségével készült
A C60 a buckyballt Sir Harold Kroto, Richard Smalley és Jr. Robert Curl fedezte fel, lézer segítségével hélium atmoszférában elpárologtatva a grafit rudakat. A szénatomokat egy- és kettős kötések kötik össze, így 12 ötszögletű és 20 hatszögletű futball-labda alakú felületet alkot. Úttörő erőfeszítéseikkel 1996-ban Nobel-díjat kapott.
A szén nanocsöveket, amelyek a buckyballs hosszúkás változatai, Iijima Sumio azonosította. Kiváló hő- és villamosenergia-vezetők, és hasznosak az elektronika számára.
A szén nanocsövek szintén lenyűgöző szakítószilárdságot mutatnak, és izgalmas alkalmazásuk van a szerkezeti anyagok és az orvostudomány területén. Az ilyen nanoanyagok ellenőrzött szintézise azonban nagy kihívást jelentett a tudósok számára.
A szén kémiai reaktivitása
A szén alkotja a földi élet alapját, milliónyi széntartalmú vegyület alkotja az összes élőlény 18 százalékát. Stabil, kovalens kötéseket képezhet más atomokkal, és hosszú láncokként vagy erősen összekapcsolódó szén-szén kötések gyűrűiként jelenhet meg. Ezek hozzájárulnak a Földön létező szénvegyületek sokféleségéhez és összetettségéhez.
Ezek szénvegyületek Szerves molekulák, például fehérjék, szénhidrátok és az élő szervezetek sejtjeiben található DNS, valamint szervetlen vegyületek, például szén-oxidok. A szerves molekulák vizsgálata a szerves kémia szakterületet képezi. A szén fémorganikus vegyületekként kovalens kötéseket is képezhet a fémmel. Ilyen példa a vas-porfirin, amely a hemoglobin oxigénkötő helye.
A szén bőséges természete ellenére normál körülmények között viszonylag nem reagál. Normál hőmérsékleten nem reagál savakkal (kénsav vagy sósav) vagy lúgokkal szemben. Ezen a hőmérsékleten stabil az oxidációval szemben is. Magasabb hőmérsékleten a szén azonban oxigénnel reagálva szén-oxidokat (CO2 és CO), kéngázzal széndiszulfidot és szilíciummal karbidokat képezve.
A szén izotópjai
A szénnek 15 ismert izotópja van, amelyek közül a szén-12 (a természetes szén 98,93 százaléka) és a 13-szén (1,07 százalék) a két stabil izotóp. A Carbon-14 a leghosszabb élettartamú izotóp, felezési ideje 5730 év. A legrövidebb élettartamú szén-izotóp a szén-8, felezési ideje 1,98739 x 10−21 másodpercig.
A szén-14 izotópot a 146C, ahol a 14 előfeltétel az atomtömeg, a 6 előjel pedig az atomszám. A C-14 nagyon alacsony természetes bőséggel rendelkezik (0,0000000001 százalék), de hosszú felezési ideje miatt hasznos radiometrikus datálás.
A 14-es szén akkor keletkezik, amikor a nitrogén-14 reagál a kozmikus sugárzás neutronjaival, és protont szabadít fel ebben a folyamatban. A szén-14 ezután az oxigénnel reagálva keletkezik 14CO2, amely egyenletesen oszlik el a légkörben a 12CO2.
147N + 10n> 146C + 11o
A szén körforgása akkor kezdődik, amikor az élő szervezetek átalakítják a szén-dioxidot (14CO2 és 12CO2 a légkörből) fotoszintézissel szerves vegyületekké, és légzéssel visszaengedik a légkörbe. Ebben az egyensúlyban fix arány van 14CO2 és 12CO2 a szervezetekben. Amikor azonban meghalnak, az egyensúly leáll, és a szén-14 béta-bomláson megy keresztül a nitrogén-14-ig annak 5730 éves felezési ideje szerint.
146C> 147N + 0-1e
A szén-14 relatív arányának mérése egy elhalt mintában így lehetővé teszi a halála után eltelt idő kiszámítását. Ezt a radiokarbon-datálás módszert széles körben alkalmazták az 500–50 000 éves kövületek és régészeti példányok keltezésére.
A Carbon-13 egy másik izotóp, amelyet számos alkalmazásban széles körben használnak. Például a magmágneses rezonanciában (NMR) használják a szerves vegyületek molekulaszerkezetének meghatározására. Címkézési eszközként használják tömegspektrométerrel együtt az orvosi kutatásokhoz is.
A szénszálak mechanikai tulajdonságai
A szén fizikai, kémiai és nukleáris tulajdonságain kívül hasznos mechanikai tulajdonságokkal is rendelkezik.
Kialakulhat ötvözetek acélból szénacélba, amelynek széntartalma 0,05-2 tömeg% között változik. A közepes széntartalmú acél (0,3–0,6% szén) egyenletes szilárdsággal és hajlékonysággal rendelkezik, valamint kiváló szakítószilárdsággal rendelkezik. Hőkezelési eljárás révén az ultra-magas szén-dioxid-tartalmú acél (1,25–2% szén-dioxid) nagy keménységűre temperálható és kés gyártására használható.
A szénrostok, amelyek 5-10 μm vastagságúak, főleg szénatomokból állnak, magasnak bizonyulnak merevség, szakítószilárdság, kémiai ellenálló képesség, hőmérséklet-tűrés és alacsony súly- és hőhatás terjeszkedés. Az acél folyási szilárdsága annak minőségétől függ, az enyhe acél hozama pedig 247 MPa. A szénszálak rendelkeznek szakítószilárdsága 1600 és 6370 MPa között mozog, ezért népszerűek a repülőgépipar, az építőmérnöki és sport.
Ha egy anyagot terhelnek, az először rugalmasan deformálódik. Ebben a szakaszban a feszültség eltávolításával visszatérhet eredeti alakjához. Folyáshatár az a stressz, amelyet egy anyag tartós alakváltozás nélkül képes ellenállni.
Amikor eléri azt a pontot (felső hozampontot), ahol már nem térhet vissza eredeti méreteihez, plasztikus deformáción megy keresztül, amely állandó és visszafordíthatatlan. A szakítószilárdság az a maximális szilárdság, amelyet egy anyag kibír, vagy megszakít.

