Le carbone est un élément non métallique avec un symbole chimique de C. C'est le quatrième élément le plus abondant de l'univers et le 15e élément le plus abondant de la croûte terrestre. C'est aussi le deuxième élément le plus abondant chez l'homme après l'oxygène. Sa composition chimique conduit à plusieurs propriétés uniques du carbone.
Le carbone appartient au groupe 14 du tableau périodique. Son numéro atomique est 6 et il a un poids atomique de 12.011. Les états d'oxydation du carbone peuvent varier de -4 à +4, où +4 existe dans des composés tels que le méthane et le disulfure de carbone, et +2 pour le monoxyde de carbone.
Les propriétés physiques des différents allotropes du carbone les rendent utiles dans les batteries, l'électronique et les nanomatériaux. Le carbone est aussi le « roi des éléments », formant presque 10 millions de composés à ce jour, y compris les composés organiques, inorganiques et organométalliques.
Les isotopes du carbone sont largement utilisés pour la datation au radiocarbone (carbone-14), la structure moléculaire et la recherche médicale (carbone-13). De plus, les fibres de carbone présentent d'excellentes propriétés mécaniques et sont populaires dans l'aérospatiale et le génie civil.
Allotropes de carbone
Le carbone a différentes formes allotropiques, avec diverses configurations moléculaires et structures atomiques. Les propriétés physiques du carbone varient considérablement avec chaque allotrope. Certains des allotropes de carbone les plus connus comprennent le graphite, le diamant et les fullerènes.
Le graphite est l'un des matériaux les plus doux connus et est utilisé dans les crayons et comme lubrifiant solide. C'est aussi un bon conducteur d'électricité, ce qui le rend utile dans les batteries et les panneaux solaires.
Le graphène est simplement une couche atomique de graphite disposée en un réseau en nid d'abeille. Dans une couche de graphène, chaque atome de carbone est lié de manière covalente à trois autres atomes, laissant le quatrième électron libre de migrer dans le plan, d'où sa conductivité électrique.
Le diamant, au contraire, est la substance naturelle la plus dure et est l'une des propriétés uniques du carbone. Il a près de deux fois la densité du graphite et chaque atome de carbone est lié tétraédriquement à quatre autres sans électrons libres. Ainsi, le diamant est un mauvais conducteur d'électricité. Le diamant est également clair en apparence, contrairement au graphite, qui est opaque.
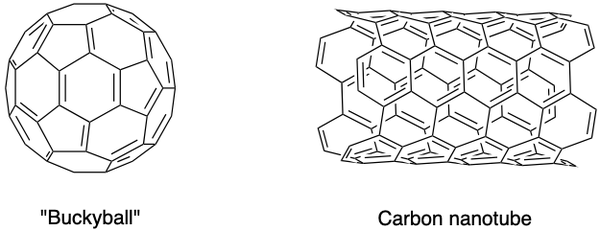
Les scientifiques ont également synthétisé d'autres allotropes de carbone, tels que les fullerènes, les nano-mousse de carbone et autres. Ils possèdent des propriétés particulières et constituent un domaine de recherche florissant dans nanomatériaux. Les fullerènes sont un groupe de molécules de carbone creuses dans une conformation en cage fermée (buckyball) ou en cylindre (nanotubes de carbone).
•••Créé à l'aide de ChemDraw
Le C60 buckyball a été découvert par Sir Harold Kroto, Richard Smalley et Robert Curl Jr., en utilisant un laser pour vaporiser des tiges de graphite dans une atmosphère d'hélium. Les atomes de carbone sont reliés entre eux par des liaisons simples et doubles pour former 12 faces pentagonales et 20 faces hexagonales en forme de ballon de football. Leurs efforts de pionniers leur ont valu le prix Nobel en 1996.
Les nanotubes de carbone, qui sont des versions allongées des buckyballs, ont été identifiés par Iijima Sumio. Ils sont d'excellents conducteurs de chaleur et d'électricité et sont utiles pour l'électronique.
Les nanotubes de carbone démontrent également une résistance à la traction impressionnante et ont des applications passionnantes dans les matériaux de structure et la médecine. Cependant, la synthèse contrôlée de ces nanomatériaux a posé un grand défi aux scientifiques.
Réactivité chimique du carbone
Le carbone constitue la base de la vie sur Terre, avec des millions de composés contenant du carbone représentant 18 % de tous les êtres vivants. Il peut former des liaisons covalentes stables avec d'autres atomes et apparaître sous forme de longues chaînes ou d'anneaux de fortes liaisons carbone-carbone interconnectées. Ceux-ci contribuent à la diversité et à la complexité des composés carbonés existant sur Terre.
Celles-ci composés de carbone comprennent des molécules organiques telles que des protéines, des glucides et de l'ADN présents dans les cellules des organismes vivants ainsi que des composés inorganiques comme les oxydes de carbone. L'étude des molécules organiques constitue un domaine spécialisé appelé chimie organique. Le carbone peut également former des liaisons covalentes avec le métal sous forme de composés organométalliques. La porphyrine de fer, qui est le site de fixation de l'oxygène de l'hémoglobine, en est un exemple.
Malgré son abondance dans la nature, le carbone est relativement peu réactif dans des conditions normales. A température normale, il n'est pas réactif vis-à-vis des acides (acide sulfurique ou acide chlorhydrique) ou des alcalis. Il est également stable à l'oxydation à cette température. À des températures plus élevées, cependant, le carbone peut réagir avec l'oxygène pour former des oxydes de carbone (CO2 et CO), avec du gaz sulfureux pour former du disulfure de carbone et avec du silicium pour former des carbures.
Isotopes de carbone
Il existe 15 isotopes connus du carbone, dont le carbone 12 (98,93 pour cent du carbone naturel) et le carbone 13 (1,07 pour cent) sont les deux isotopes stables. Le carbone 14 est l'isotope à la vie la plus longue, avec une demi-vie de 5 730 ans. L'isotope du carbone à la durée de vie la plus courte est le carbone-8 et sa demi-vie est de 1,98739 x 10−21 secondes.
L'isotope carbone-14 est représenté par 146C, où le préindice 14 est la masse atomique et le préindice 6 est le numéro atomique. Le carbone 14 a une très faible abondance naturelle (0,000000001 pour cent), mais sa longue demi-vie le rend utile pour datation radiométrique.
Le carbone-14 se forme lorsque l'azote-14 réagit avec les neutrons du rayonnement cosmique, libérant un proton au cours de ce processus. Le carbone 14 réagit alors avec l'oxygène pour générer 14CO2, qui est uniformément répartie dans l'atmosphère avec 12CO2.
147N + 10n > 146C + 11p
Le cycle du carbone commence lorsque les organismes vivants convertissent le dioxyde de carbone (14CO2 et 12CO2 de l'atmosphère) en composés organiques par photosynthèse et les relâcher dans l'atmosphère par respiration. Dans cet équilibre, il existe un rapport fixe de 14CO2 et 12CO2 dans les organismes. Cependant, lorsqu'ils meurent, l'équilibre s'arrête et le carbone 14 subit une désintégration bêta en azote 14 selon sa demi-vie de 5 730 ans.
146C > 147N + 0-1e
La mesure de la proportion relative de carbone 14 dans un spécimen mort permet ainsi de calculer le temps écoulé après sa mort. Cette méthode de datation au radiocarbone a été largement utilisée pour dater des fossiles et des spécimens archéologiques de 500 à 50 000 ans.
Le carbone-13 est un autre isotope largement utilisé dans de nombreuses applications. Par exemple, il est utilisé en résonance magnétique nucléaire (RMN) pour déterminer les structures moléculaires des composés organiques. Il est également utilisé comme outil d'étiquetage en combinaison avec un spectromètre de masse pour la recherche médicale.
Propriétés mécaniques des fibres de carbone
Le carbone présente également des propriétés mécaniques utiles, autres que ses propriétés physiques, chimiques et nucléaires.
Il peut former alliages avec de l'acier en acier au carbone, dont la teneur en carbone varie de 0,05 à 2 pour cent en poids. L'acier à teneur moyenne en carbone (0,3-0,6 pour cent de carbone) a une résistance et une ductilité équilibrées, ainsi qu'une excellente résistance à la traction. Grâce à un processus de traitement thermique, l'acier à ultra-haute teneur en carbone (1,25 à 2 % de carbone) peut être trempé à une grande dureté et utilisé pour la fabrication de couteaux.
Les fibres de carbone, qui sont des fibres de 5 à 10 m d'épaisseur composées principalement d'atomes de carbone, présentent une haute rigidité, résistance à la traction, résistance chimique, tolérance à la température et faible poids et thermique expansion. La limite d'élasticité de l'acier dépend de sa nuance et l'acier doux a une limite d'élasticité de 247 MPa. Les fibres de carbone ont résistances à la traction allant de 1 600 à 6 370 MPa et sont donc populaires dans le domaine de l'aérospatiale, du génie civil et des sports.
Lorsqu'une contrainte est exercée sur un matériau, celui-ci se déforme élastiquement dans un premier temps. A ce stade, il peut reprendre sa forme initiale lorsque la contrainte est supprimée. Limite d'élasticité est définie comme la contrainte qu'un matériau peut supporter sans déformation permanente.
Lorsqu'il atteint un point (limite supérieure d'élasticité) où il ne peut plus revenir à ses dimensions d'origine, il subit une déformation plastique, qui est permanente et irréversible. La résistance à la traction est la résistance maximale à laquelle un matériau peut résister sans se rompre ni se casser.
