Vous avez probablement déjà rencontré des piles à plat, ce qui est gênant si vous essayez de les utiliser dans des appareils électroniques. La chimie des cellules des batteries peut vous indiquer les propriétés de leur fonctionnement, y compris la façon dont elles se dégonflent.
Chimie cellulaire des batteries
•••Syed Hussain Ather
Lorsque la réaction électrochimique d'une batterie épuise les matériaux, la batterie se décharge. Cela se produit généralement après une longue période d'utilisation de la batterie.
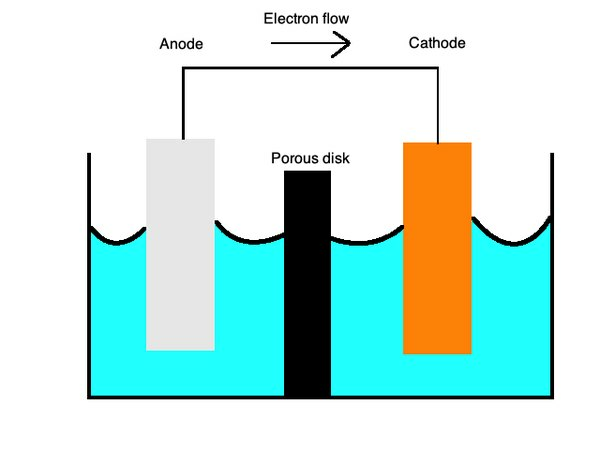
Les batteries utilisent généralement des cellules primaires, un type depile galvaniquequi utilise deux métaux différents dans un électrolyte liquide pour permettre le transfert de charge entre eux. Les charges positives s'écoulent ducathode, construit avec des cations ou des ions chargés positivement tels que le cuivre, auanode, avec des anions ou des ions chargés négativement comme le zinc.
Conseils
Les batteries se déchargent en raison du dessèchement des produits chimiques de l'électrolyte dans la batterie. Dans le cas des piles alcalines, c'est lorsque tout le dioxyde de manganèse a été converti. A ce stade, la batterie est à plat.
Pour vous souvenir de cette relation, vous pouvez vous souvenir du mot « OILRIG ». Cela vous dit quel'oxydation est une perte(« HUILE ») etla réduction est un gain(« RIG ») d'électrons. lemnémonique pour anodes et cathodes est "ANOX REDCAT" pour se rappeler que "ANode" est utilisé avec "OXidation" et "REDuction" se produit au "CAThode".
Les cellules primaires peuvent également fonctionner avec des demi-cellules individuelles de différents métaux dans une solution ionique reliées par un pont salin ou une membrane poreuse. Ces cellules fournissent aux batteries une multitude d'utilisations.
Piles alcalines, qui utilisent spécifiquement la réaction entre une anode de zinc et une cathode de magnésium, sont utilisés pour les lampes de poche, les appareils électroniques portables et les télécommandes. D'autres exemples d'éléments de batterie populaires incluent le lithium, le mercure, le silicium, l'oxyde d'argent, l'acide chromique et le carbone.
Les conceptions techniques peuvent tirer parti de la façon dont les batteries se déchargent pour conserver et réutiliser l'énergie. Les piles domestiques bon marché utilisent généralement des cellules carbone-zinc conçues de telle sorte que, si le zinc subitcorrosion galvanique, un processus dans lequel un métal se corrode préférentiellement, la batterie peut produire de l'électricité dans le cadre d'un circuit électronique fermé.
A quelle température les batteries explosent-elles? La chimie des cellules des batteries lithium-ion signifie que ces batteries déclenchent des réactions chimiques qui entraînent leur explosion à environ 1 000 °C. Le cuivre à l'intérieur fond, ce qui provoque la rupture des noyaux internes.
Histoire de la cellule chimique
En 1836, le chimiste britannique John Frederic Daniell a construit leCellule Danielldans lequel il a utilisé deux électrolytes, au lieu d'un seul, pour laisser l'hydrogène produit par l'un être consommé par l'autre. Il utilisait du sulfate de zinc à la place de l'acide sulfurique, pratique courante des batteries de l'époque.
Avant cela, les scientifiques utilisaient des cellules voltaïques, un type de cellule chimique qui utilise une réaction spontanée, qui perdait de la puissance à un rythme rapide. Daniell a utilisé une barrière entre les plaques de cuivre et de zinc pour empêcher l'excès d'hydrogène de bouillonner et empêcher la batterie de s'user rapidement. Son travail conduirait à des innovations en télégraphie et en électrométallurgie, la méthode d'utilisation de l'énergie électrique pour produire des métaux.
Comment les piles rechargeables s'épuisent
Cellules secondaires, en revanche, sont rechargeables. La batterie rechargeable, également appelée batterie de stockage, cellule secondaire ou accumulateur, stocke la charge au cours du temps car la cathode et l'anode sont connectées en circuit l'une à l'autre.
Lors de la charge, le métal actif positif tel que l'hydroxyde d'oxyde de nickel s'oxyde, créant des électrons et les perdre, tandis que le matériau négatif tel que le cadmium est réduit, capturant des électrons et gagnant eux. La batterie utilise des cycles de charge-décharge en utilisant une variété de sources, y compris l'électricité à courant alternatif comme source de tension externe.
Les batteries rechargeables peuvent encore se décharger après une utilisation répétée car les matériaux impliqués dans la réaction perdent leur capacité à se charger et à se recharger. Au fur et à mesure que ces systèmes de batteries s'usent, les batteries se déchargent de différentes manières.
Comme les batteries sont utilisées régulièrement, certaines d'entre elles, telles que les batteries au plomb, peuvent perdre leur capacité de recharge. Le lithium des batteries lithium-ion peut devenir du lithium métal réactif qui ne peut pas réintégrer le cycle de charge-décharge. Les batteries à électrolytes liquides peuvent perdre leur humidité en raison de l'évaporation ou de la surcharge.
Applications des batteries rechargeables
Ces batteries sont généralement utilisées dans les démarreurs d'automobiles, les fauteuils roulants, les vélos électriques, les outils électriques et les centrales électriques de stockage de batteries. Les scientifiques et les ingénieurs ont étudié leur utilisation dans les véhicules hybrides à combustion interne et les véhicules électriques pour devenir plus efficaces dans leur consommation d'énergie et durer plus longtemps.
La batterie au plomb rechargeable brise les molécules d'eau (H2O) dans une solution aqueuse d'hydrogène (H+) et des ions oxyde (O2-) qui produit de l'énergie électrique à partir de la liaison rompue lorsque l'eau perd sa charge. Lorsque la solution aqueuse d'hydrogène réagit avec ces ions oxyde, les fortes liaisons O-H sont utilisées pour alimenter la batterie.
Physique des réactions de batterie
Cette énergie chimique alimente une réaction d'oxydoréduction qui convertit les réactifs à haute énergie en produits à plus faible énergie. La différence entre les réactifs et les produits permet à la réaction de se produire et forme un circuit électrique lorsque la batterie est branchée en convertissant l'énergie chimique en énergie électrique.
Dans une cellule galvanique, les réactifs, tels que le zinc métallique, ont une énergie libre élevée qui permet à la réaction de se produire spontanément sans force externe.
Les métaux utilisés dans l'anode et la cathode ont des énergies de cohésion de réseau qui peuvent entraîner la réaction chimique. L'énergie de cohésion du réseau est l'énergie nécessaire pour séparer les atomes qui composent le métal les uns des autres. Le zinc métallique, le cadmium, le lithium et le sodium sont souvent utilisés car ils ont des énergies d'ionisation élevées, l'énergie minimale requise pour éliminer les électrons d'un élément.
Les cellules galvaniques entraînées par des ions du même métal peuvent utiliser des différences d'énergie libre pour que l'énergie libre de Gibbs entraîne la réaction. leL'énergie gratuite de Gibbsest une autre forme d'énergie utilisée pour calculer la quantité de travail qu'un processus thermodynamique utilise.
Dans ce cas, le changement de l'énergie libre de Gibbs standardgo entraîne la tension ou la force électromotriceEoen volts, selon l'équation
E^{\text{o}}=\frac{-\Delta_rG^{\text{o}}}{v_eF}
dans lequelveest le nombre d'électrons transférés au cours de la réaction et F est la constante de Faraday (F = 96485.33 C mol−1).
leΔrgo indique que l'équation utilise la variation de l'énergie libre de Gibbs (Δrgo =gfinal - ginitiale).L'entropie augmente à mesure que la réaction utilise l'énergie libre disponible. Dans la cellule Daniell, la différence d'énergie de cohésion du réseau entre le zinc et le cuivre représente la majeure partie de la différence d'énergie libre de Gibbs lorsque la réaction se produit.Δrgo= -213 kJ/mol, qui est la différence d'énergie libre de Gibbs des produits et celle des réactifs.
Tension d'une cellule galvanique
Si vous séparez la réaction électrochimique d'une cellule galvanique en demi-réactions d'oxydation et de réduction processus, vous pouvez additionner les forces électromotrices correspondantes pour obtenir la différence de tension totale utilisée dans le cellule.
Par exemple, une cellule galvanique typique peut utiliser CuSO4 et ZnSO4 avec des demi-réactions potentielles standard telles que :Cu2+ + 2 e− Cuavec un potentiel électromoteur correspondantEo = +0,34 VetZn2+ + 2 e− Znavec potentielEo = -0,76 V.
Pour la réaction globale,Cu2+ + Zn Cu + Zn2+ , vous pouvez "inverser" l'équation de demi-réaction pour le zinc tout en inversant le signe de la force électromotrice pour obtenirZn ⇌ Zn2+ + 2 e− avecEo = 0,76 V.Le potentiel de réaction global, somme des forces électromotrices, est alors+0.34V − (−0,76 V) = 1,10 V.
