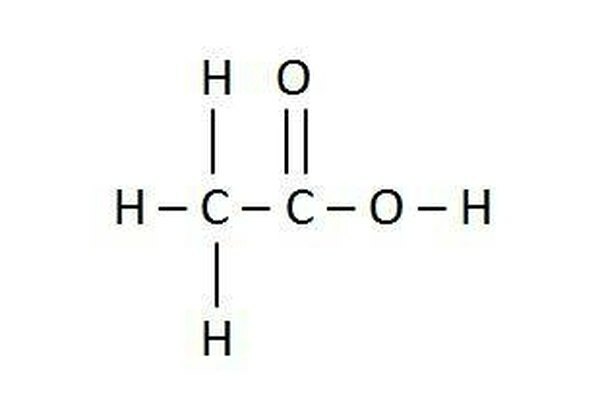
Kemiallinen kaava on yksinkertaistettu, standardimerkintä kokeissa käytetyn kemiallisen reaktion selittämiseksi. Ne saattavat näyttää monimutkaisilta, mutta kun opit lukemaan ne, niistä tulee melko itsestään selviä.
Katsokaa kemiallista reaktiota, jota yrität hajottaa yhtälöksi. Etsi avainsanoja, erityisesti mukana olevat kemialliset komponentit. Esimerkiksi metaani (CH4) poltetaan, mikä tarkoittaa aina sitä, että se tapahtuu hapessa (O2). Tämä tuottaa sekä hiilidioksidi- (CO2) että vesihöyryä. Huomaa sanan "Tuotto" sijainti, koska tämä on tärkeää.
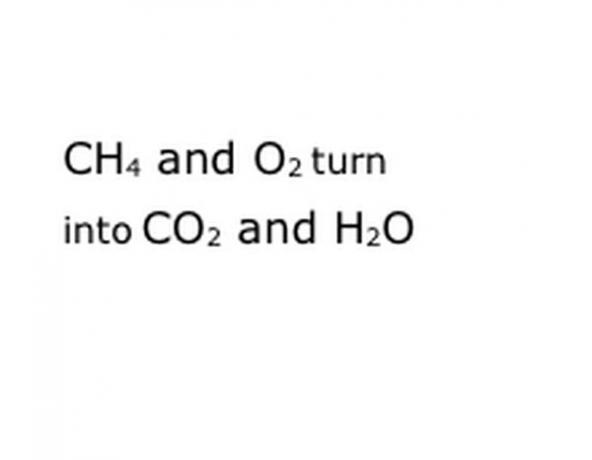
Kirjoita reaktion kemialliset komponentit vakiomerkintämuotoon. Esimerkissämme tämä on CH4, O2, CO2 ja H20. Kemiassa "saanto" tarkoittaa, että mikä tahansa ennen muuttuu mitä tulee jälkeenpäin, joten muista, että "tuotto" on suunnilleen keskellä. Tämä lause edustaa todellista kemiallista reaktiota, tässä tapauksessa palamista. Joten kaiken, mitä poltat, on oltava ennen sitä, ja kaiken, minkä reaktio tuottaa, on oltava sen jälkeen.
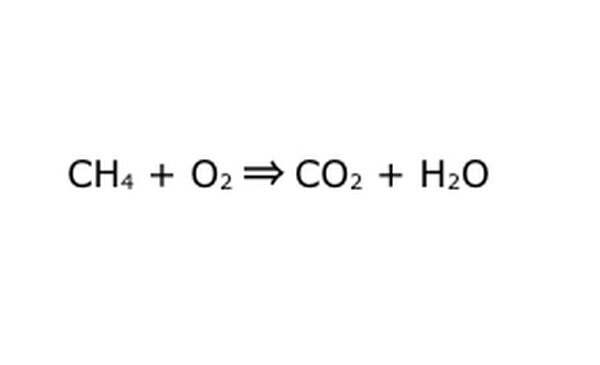
Kirjoita yhtälö uudelleen matemaattisena prosessina. Korvaa "saanto" tai "muuttuu" nuoleksi ja piirrä plusmerkit kemiallisten komponenttien väliin. Yksinkertaistaaksesi, ajattele jokaista kemiallista komponenttia erillisenä molekyylinä. Se voi auttaa vetämään molekyylit pois romupaperille. Varmista, että kaikki sisään menevät molekyylit ovat edustettuina. Jos lopputuotteesta puuttuu jotain, voit lisätä sen järkevällä tavalla - tarkista kaikki sen suhteen, mitä tiedät kovalenttisesta sidoksesta. Koska suurin osa kokeista tehdään normaalissa ilmakehässä, voit lisätä O2: ta tarvittaessa polttoreaktioihin. Jos yhtälö on palautuva, varmista, että siinä on kaksoisnuoli.
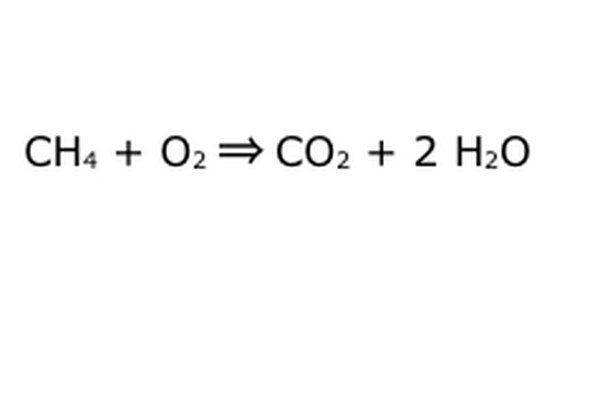
Tasapainota yhtälösi. Tässä tulee esiin luonnonsuojelulaki: Ajattele nuolta, reaktiomme, koneena, johon olet upottanut kaikki komponentit vasemmalla puolella. Kone ei tee tai lisää mitään, mitä et ole asettanut sisään, ja siksi se sylkee vain saman määrän tavaroita kuin mitä laitat. Tällä hetkellä meillä on kaksi ylimääräistä vetymolekyyliä kelluvan ympärillä, koska laitat "4" sisään. Ainoa paikka, johon se voi mennä tässä koneessa, on yksi tuotteista, joten sen on mentävä vesimolekyyleihin. Kirjoita "2" H2O: n eteen osoittamaan, että jokaisesta laitetusta CH4: stä saat kaksi H2O: ta takaisin.

Huomaa, että yhtälössä on edelleen pieni ongelma: happea ei ole tarpeeksi. Happiatomeja on neljä, mutta sisään menee vain kaksi, joten koko asia on edelleen epätasapainossa. Kirjoita "2" O2: n eteen osoittamaan, että sinun täytyy laittaa kaksi O2: ta saadaksesi tarpeeksi reaktiosta.
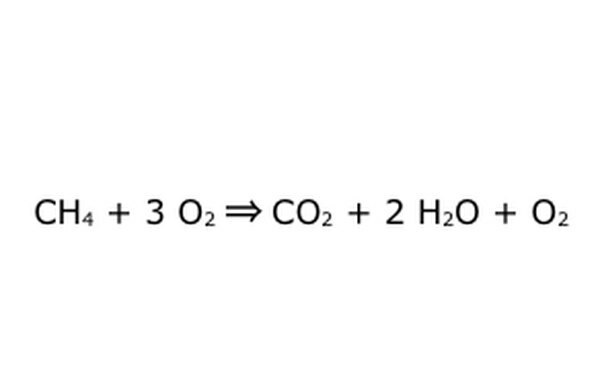
Huomaa, että tällainen prosessi on mahdollista tehdä "ylimääräisessä hapessa". Tämä tarkoittaa sitä, että yhtälö tuo enemmän happea kuin tarvitaan, ja saa enemmän takaisin. Esimerkiksi, huomaa, että sisään menee ylimääräinen O2, joten ylimääräinen tulee ulos. Varmista vain, että suojelulakia noudatetaan jatkuvasti. Kaikkien sisään menevien on oltava esillä.
Vinkkejä
Yleensä kemikaalit tämän tyyppisissä yhtälöissä mitataan mooleina. Mooli on yksikkö, joka edustaa 6,0221415 10 ^ (23) molekyyliä. Koska tämä on luku, joka on aivan liian suuri ymmärrettäväksi, on helpompaa ajatella yksittäisten molekyylien suhteen tasapainotettaessa. Ole tietoinen tästä aloittaessasi.