Keemiline valem on lihtsustatud standardmärge katsetes kasutatud keemilise reaktsiooni selgitamiseks. Need võivad tunduda keerulised, kuid kui õpid neid lugema, muutuvad nad üsna iseenesestmõistetavaks.
Vaadake võrrandina keemilist reaktsiooni, mida proovite lagundada. Otsige märksõnu, täpsemalt keemilisi komponente. Näiteks põletatakse metaani (CH4), mis tähendab alati, et see toimub hapnikus (O2). See annab nii süsinikdioksiidi (CO2) kui ka veeauru (H2O). Pange tähele sõna "Saagikus" asukohta, kuna see on oluline.
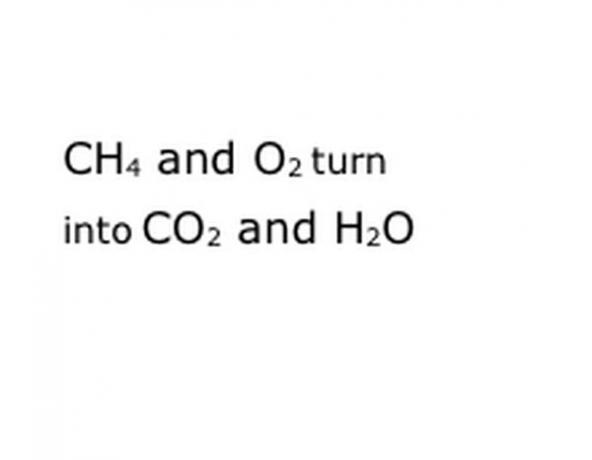
Kirjutage reaktsiooni keemilised komponendid standardses tähistusvormingus. Meie näites on selleks CH4, O2, CO2 ja H2O. Keemias tähendab "saagikus" seda, et kõik, mis on enne, muutub igaks, mis järgneb, seega ole kindel, et "saagikus" on umbes keskel. See fraas tähistab tegelikku keemilist reaktsiooni, antud juhul põletamist. Nii et kõik, mida te põletate, peab olema enne seda ja kõik, mida reaktsioon annab, peab olema pärast seda.
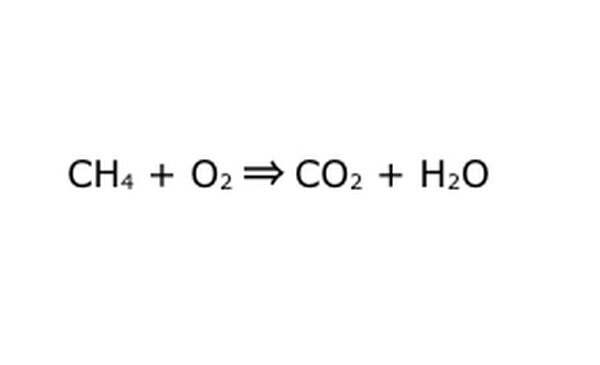
Kirjutage võrrand uuesti matemaatilise protsessina. Asendage "saagis" või "muutub" noolega ja joonistage keemiliste komponentide vahele plussmärgid. Asjade lihtsustamiseks mõelge igale keemilisele komponendile kui eraldi molekulile. See võib aidata molekulide väljajätmist paberijääkidele. Veenduge, et kõik sisse minevad molekulid oleksid esindatud väljumas. Kui lõpptoodangust midagi puudu on, võite selle lisada mõistlikul viisil - kontrollige kõike selle järgi, mida teate kovalentse sidumise kohta. Kuna enamik katseid tehakse tavalises atmosfääris, võite vajadusel lisada O2 põletusreaktsioonidele. Kui võrrand on pöörduv, veenduge, et sellel oleks topeltnool.
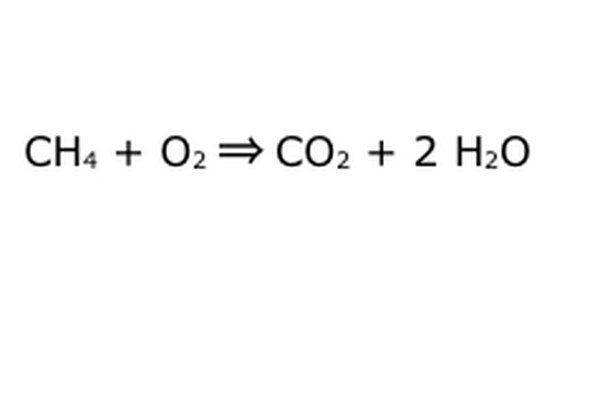
Tasakaalustage oma võrrand. Siin tuleb mängu konserveerimisseadus: mõelge noolele, meie reaktsioonile kui masinale, kuhu olete kõik vasakpoolsed komponendid visanud. Masin ei tee ega lisa midagi, mida te pole sisse pannud, ja seetõttu sülitab see välja ainult sama koguse kraami, mille sisse panite. Sel täpsel hetkel hõljub meil ringi kaks vesiniku üleliigset molekuli, kuna panete "4" sisse. Ainus koht, kus see selles masinas võib käia, on üks toodetest, nii et see peab minema veemolekulidesse. Kirjutage H2O ette "2", mis näitab, et iga teie sisestatud CH4 eest saate kaks H2O tagasi.

Pange tähele, et meie võrrandiga on endiselt väike probleem: hapnikku ei ole piisavalt. Välja tuleb neli hapniku aatomit, kuid sisse läheb ainult kaks ja nii on kogu asi endiselt tasakaalust väljas. Kirjutage O2 ette "2", et tähistada, et reaktsioonist piisavalt väljumiseks peate panema kaks O2.
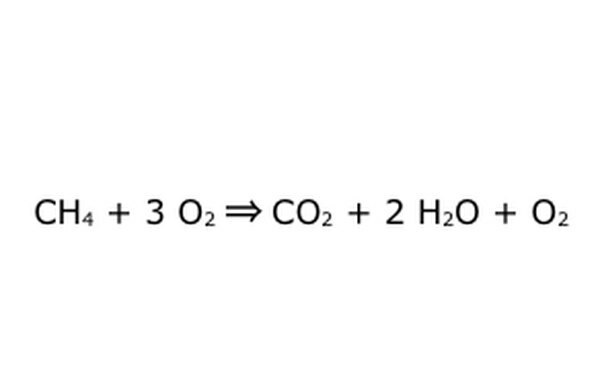
Pange tähele, et sellist protsessi on võimalik teha "hapniku liias". See tähendab, et võrrand paneb rohkem hapnikku kui vaja ja saab rohkem tagasi. Näiteks pange tähele, et sisse läheb täiendav O2, seega tuleb välja lisa. Lihtsalt veenduge, et looduskaitseseadust järgitakse alati. Kõik, mis sisse läheb, peab välja tulema.
Näpunäited
Üldiselt mõõdetakse seda tüüpi võrrandites olevaid kemikaale moolides. Mool on üksus, mis tähistab 6,0221415 10 ^ (23) molekuli. Kuna see on arv, mis on arusaamiseks liiga suur, on tasakaalustamisel lihtsam mõelda üksikute molekulide mõistes. Alustades olge sellest teadlik.
