Kõik, millega igapäevaselt suhtlete, koosneb lõpuks aatomitest. Näiteks 200 ml klaas vett sisaldab umbes 6,7 × 1024 molekule ja kuna aatomite arv igas molekulis on kolm, on neid kokku umbes 2 × 1025 aatomid just selles ühes klaasis. See on 20 miljonit miljardit miljardit - nii suur arv, et te ei suuda seda tegelikult isegi ette kujutada - ja see on lihtsalt üsna väikeses veeklaasis. Nendest ainete väikestest koostisosadest aru saamine on ülioluline samm igapäevaselt tuttavate makroskoopiliste omaduste mõistmiseks.
Kuid kuidas saate isegi arvutada midagi sellist nagu aatomite arv veeklaasis? Selle konkreetse juhtumi trikk olimolaarmassvett ja teadaolev arv aatomeid mis tahes aine moolis. Kuid molaarmass sõltub omakordaaatommassiühik, mida on ülioluline mõista iga füüsika- või keemiatudengi jaoks. Õnneks on see tõesti mis tahes aine aatomi tegeliku massi lihtsustamine, mis sisuliselt ütleb teile suhtelise massi võrreldes ühe neutroni või prootoniga.
Aatomistruktuur
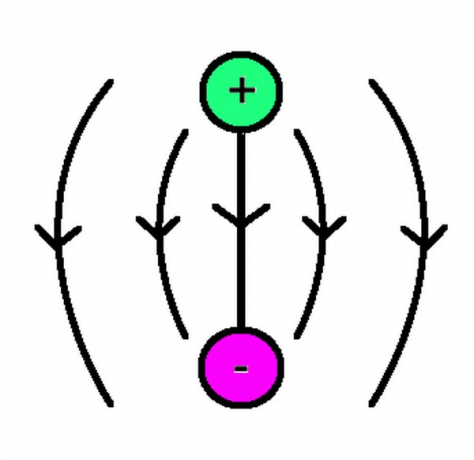
Aatomitel on kolm peamist komponenti: prootonid, neutronid ja elektronid. Prootonid ja neutronid eksisteerivad tuuma sees, mis on aine kompaktne paigutus, mis asetseb aatomi keskel, ja elektronid eksisteerivad kui "udune pilv" selle välisküljel. Tuuma ja isegi lähima elektroni vahel on tohutult ruumi. Tuumal on positiivne laeng, kuna prootonid on positiivselt laetud ja neutronid on neutraalsed, samal ajal kui elektronide pilv kannab negatiivset laengut, mis tasakaalustab seda neutronist.
Tuum sisaldab põhiosa aatomi massist, kuna neutronid ja prootonid on palju-palju raskemad kui elektronid. Tegelikult on kas prootonid või neutronid umbes 1800 korda suuremad kui elektronid, nii palju suuremad kui sisse paljudel juhtudel võite elektroni massi ohutult unarusse jätta, kui mõtlete rohkem aatomimassi peale üldiselt.
Aatomnumber
Perioodiline tabel loetleb kõik looduses leiduvad elemendid (st aatomi tüübid), alustades kõige lihtsamast, milleks on vesinikuaatom. Theaatomnumberaatomi (antud sümbolZ) ütleb teile, kui palju prootoneid on elemendi aatomil tuumas ja see on perioodilise tabeli vastava ploki ülemine number. Sest see kannab endas positiivset laengut ja elektronide arvu (mis on oluline teave, kui olete mõeldes aatomühendusele) peab olema võrdne sellega üldise elektrilise neutraalsusega, see arv iseloomustab tõepoolest element.
Neid võib olla erinevaidisotoopidsamast elemendist, millel on sama arv prootoneid (ja seega võib seda mõistlikult arvata sama elemendina), kuid erinev neutronite arv. Need võivad olla stabiilsed või mitte, mis on iseenesest huvitav teema, kuid on oluline märkida praegu on see, et erinevatel isotoopidel on erinev mass, kuid enamikul teistel on samad üldised omadused viise.
Kuigi tavalisel kujul olevad aatomid on elektriliselt neutraalsed, on mõned aatomid altid elektrone omandama või kaotama, mis võib anda neile neto elektrilaengu. Aatomid, mis on läbinud ühe neist protsessidest, nimetatakse ioonideks.
Aatomimass
Aatomimassi määratletakse tavaliselt aatommassiühikutes (amu). Ametlik määratlus on, et 1 amu on 1/12 süsinik-12 aatomi massist. Siinkohal on süsinik-12 tavaline viis öelda „kuue prootoni ja kuue süsiniku isotoop neutronid, ”nii et lõppkokkuvõttes võite mõelda aatomi massiühikule kas prootoni või neutron. Nii et teatud mõttes on aatommassinumber prootonite ja neutronite arv tuumas ja see tähendab, et see ei ole sama mis aatomnumber,Z.
Oluline on märkida, et viimases osas selgitatud põhjustel unustatakse aatomi elektronide mass, kui räägite aatommassist enamikus olukordades. Teine huvitav märkus on see, et aatomi mass on tegelikult veidi väiksem kui kõigi komponentide mass kokku, kuna tuuma kooshoidmiseks kulub „sidumisenergia“. Kuid see on veel üks komplikatsioon, mida te enamikus olukordades tegelikult arvestama ei pea.
Perioodilisustabeli elemendi ploki madalam arv on keskmine aatommass, mis erineb ka aatommassiühikutes väljendatud massist. See on sisuliselt elemendi erinevate isotoopide masside kaalutud keskmine, võttes arvesse nende suhtelist arvukust Maal. Nii et mõnes mõttes on see elemendi massi kõige täpsem "üldine" mõõt, kuid praktikas on konkreetse isotoobi aatomimass aatomimassi ühikutes täisarv. Lihtsamatel perioodilistel tabelitel on see “aatommassi number” (A) kasutatakse keskmise aatommassi asemel.
Molekulmass
Themolekulmass(või vähem täpset, kuid ka levinud terminit kasutades - "molekulmass") on aine molekuli mass aatomimassi ühikutes. Selle väljatöötamine on tõesti lihtne: leiate kõnealuse aine keemilise valemi ja liidate seejärel koostisosade aatomite aatommassid. Näiteks koosneb metaan ühest süsinikuaatomist ja neljast vesinikuaatomist ning seega on nende komponentide mass ühendatud. Ühe süsinik-12 aatomi aatomimass on 12 ja iga vesinikuaatomi aatomimass on 1, seega on metaanmolekuli kogu molekulmass 16 amu.
Molaarmass
Aine molaarmass on aine ühe mooli mass. See põhineb Avogadro arvul, mis ütleb aatomite või molekulide arvu ühes aine moolis ja mooli määratlusel. Mool on aine kogus, mille mass on grammides sama, mis selle aatomimassi number. Nii et näiteks süsinik-12 puhul on ühe mooli mass 12 g.
Avogadro number on 6,022 × 1023ja seega sisaldab 12 g süsinik-12 nii palju aatomeid ja samamoodi sisaldab nii palju aatomeid 4 g heeliumi. Oluline on meeles pidada, et kui kõnealune aine on molekul (st midagi, mis koosneb rohkem kui ühest aatomist), siis Avogadro number ütleb teilemolekulidmitte aatomite arv.
See annab teile kõik, mida peate teadma, et tutvustada sissejuhatuses näiteks sellist veeklaasi. Klaas sisaldas 200 ml, mis vastab 200 g massilt, ja ühte veemolekuli (keemiline valem H2O) on kaks vesiniku aatomit ja üks hapniku aatom molekulmassiks 18 amu ja molaarmassiks 18 g. Nii et aatomite arvu leidmiseks jagage mass lihtsalt mooli massiga, et leida moolide arv, ja korrutate seejärel molekulide arvu leidmiseks Avogadro numbriga. Lõpuks, märkides, et igal molekulil on kolm aatomit, korrutatakse kolmega, et leida üksikute aatomite arv.
\ begin {joondatud} text {Moolide arv} & = \ frac {200 \ text {g}} {18 \ text {g / mol}} \\ & = 11.111 \ text {mol} \\ \ text {Number molekulidest} & = 11.111 \ text {mol} × 6.022 × 10 ^ {23} \ text { molekulid / mol} \\ & = 6,7 × 10 ^ {24} \ text {molekulid} \\ \ text {aatomite arv} & = 6,7 × 10 ^ {24} \ text {molekulid} × 3 \ text {aatomid / molekul} \\ & = 2 × 10 ^ {25} \ text {aatomit} \ end {joondatud}
Näited - süsiniku mass
Rohkemate näidete läbitöötamine aitab teil mõista aatomimassi põhimõisteid. Lihtsaim näide on lihtsa elemendi nagu süsinik-12 massi väljatöötamine. Protsess on tõesti lihtne, kui mõtlete ainult amu mõttes, kuid saate ka amu kilogrammideks teisendada, et saada süsiniku massi ühtlasem mõõtmine.
Teil peaks olema võimalik arvutada süsiniku aatomi mass amu põhjal selle põhjal, mida olete artiklist juba õppinud, ja märkides, et igas aatomis on kuus prootonit ja kuus neutronit. Mis on siis süsinikuaatomi mass amu? Muidugi on see 12 amu. Lisate kuus prootonit kuuele neutronile ja leiate vastuse, kuna mõlema tüüpi osakeste mass on 1 amu.
Amu teisendamine kilogrammiks on ka sellest punktist üsna lihtne: 1 amu = 1,66 × 10−27 kg, nii et
12 \ text {amu} = 12 \ text {amu} \ korda 1,66 \ korda 10 ^ {- 27} \ text {kg / amu} = 1,99 \ korda 10 ^ {- 26} \ text {kg}
See ontõestiväike mass (ja sellepärast mõõdetakse aatomimassi tavaliselt amu), kuid väärib märkimist, et elektroni mass on umbes 9 × 10−31, seega on selge, et isegi kõigi 12 elektronide lisamine süsinikuaatomi massile ei oleks märkimisväärset vahet teinud.
Näited - molekulmass
Molekulmass on natuke keerulisem kui lihtsalt aatomi massi väljatöötamine, kuid kõik, mida peate tegema do on vaadata molekuli keemilist valemit ja ühendada üksikute aatomite massid, et leida kokku. Näiteks proovige arvutada benseeni mass, mille keemiline valem on: C6H6, märkides, et need on süsinik-12 aatomid ja see on pigem vesiniku kui deuteeriumi või triitiumi tavaline isotoop.
Peamine on märkamine, et teil on kuus süsinik-12 ja kuus vesiniku aatomit, seega on molekuli mass:
\ begin {joondatud} text {Molecular mass} & = (6 × 12 \ text {amu}) + (6 × 1 \ text {amu}) \\ & = 72 \ text {amu} + 6 \ text {amu } \\ & = 78 \ text {amu} \ end {joondatud}
Molekulmassi leidmise protsess võib suuremate molekulide jaoks veidi keerulisemaks muutuda, kuid see järgib alati sama protsessi.
Näited - keskmise aatomimassi arvutamine
Elemendi keskmise aatommassi leidmine hõlmab mõlema aatommassi arvestamistjakonkreetse isotoobi suhteline arvukus Maal. Süsinik on selle hea näide, sest 98,9 protsenti kogu maakera süsinikust on süsinik-12, millest 1,1 protsenti on süsinik-13 javägaväike protsent on süsinik-14, mida võib julgelt unarusse jätta.
Selle väljatöötamise protsess on tegelikult üsna lihtne: korrutage isotoobi osakaal isotoobi massiga amu ja lisage need kaks kokku. Süsinik-12 on kõige tavalisem süsiniku isotoop, seega võite eeldada, et tulemus on väga lähedal 12 amu-le. Enne arvutamist peate protsendid teisendama kümnendkohtadeks (jagage need 100-ga) ja saate õige vastuse:
(12 \ text {amu} × 0.989) + (13 \ text {amu} × 0.011) = 12.011 \ text {amu}
See tulemus on täpselt see, mida leiate perioodilisustabelilt, kus on loetletud keskmine aatommass, mitte kõige tavalisema isotoobi mass.