Una fórmula química es una notación estándar simplificada para explicar una reacción química utilizada en experimentos. Pueden parecer complicados, pero cuando aprendes a leerlos, se explican por sí mismos.
Mire la reacción química que está tratando de descomponer como una ecuación. Busque palabras clave, específicamente los componentes químicos involucrados. Por ejemplo, el metano (CH4) se quema, lo que siempre significa que se hace en oxígeno (O2). Esto produce tanto dióxido de carbono (CO2) como vapor de agua (H2O). Tenga en cuenta la ubicación de la palabra "Rendimientos", ya que es importante.
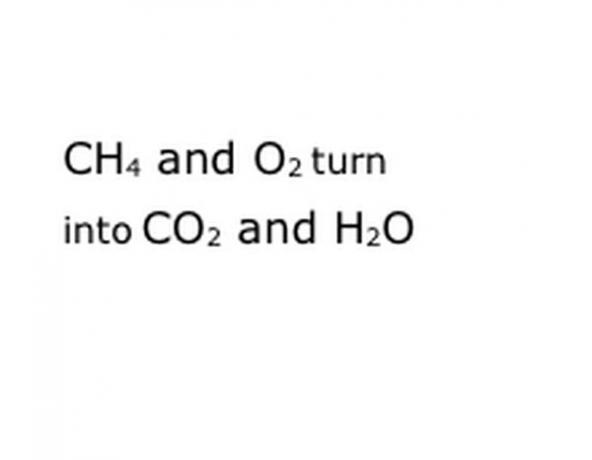
Escribe los componentes químicos de la reacción en el formato de notación estándar. En nuestro ejemplo, será CH4, O2, CO2 y H2O. En química, "ceder" significa que todo lo que está antes se convierte en lo que viene después, así que asegúrese de que el "rendimiento" esté aproximadamente en el medio. Esa frase representará la reacción química real, en este caso la quema. Por lo tanto, todo lo que queme debe estar antes, y cualquier cosa que produzca la reacción debe ser después.
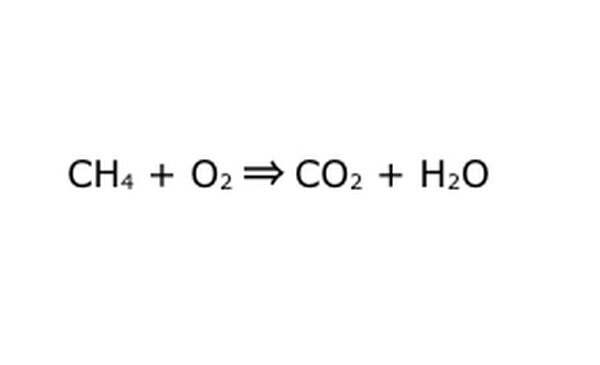
Reescribe la ecuación como un proceso matemático. Reemplace "rendimiento" o "se convierte en" con una flecha y dibuje el signo más entre los componentes químicos. Para simplificar las cosas, piense en cada componente químico como una molécula individual. Puede ser útil extraer las moléculas en un trozo de papel. Asegúrese de que todas las moléculas que entran estén representadas saliendo. Si falta algo en el producto final, puede agregarlo de una manera que tenga sentido: verifique cualquier cosa con lo que sabe sobre la unión covalente. Como la mayoría de los experimentos se realizan en la atmósfera normal, puede agregar O2 si es necesario a las reacciones de combustión. Si la ecuación es reversible, asegúrese de que tenga una flecha doble para representarla.
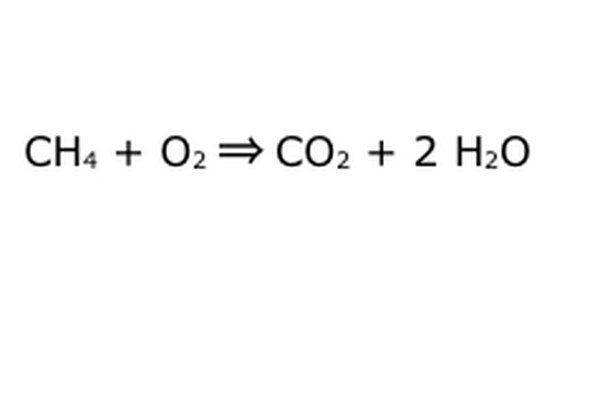
Equilibra tu ecuación. Aquí es donde entra en juego la Ley de Conservación: piense en la flecha, nuestra reacción, como una máquina en la que ha vertido todos los componentes de la izquierda. La máquina no producirá ni agregará nada que usted no haya puesto y, por lo tanto, solo escupirá la misma cantidad de material que colocó. En este preciso momento, tenemos dos moléculas de hidrógeno en exceso flotando alrededor, porque pones "4". El único lugar al que puede ir en esta máquina es a uno de los productos, por lo que tendrá que ir a las moléculas de agua. Escriba un "2" delante del H2O para indicar que por cada CH4 que introduzca, obtendrá dos H2O de vuelta.

Tenga en cuenta que todavía hay un pequeño problema con nuestra ecuación: no entra suficiente oxígeno. Hay cuatro átomos de oxígeno que salen, pero solo dos entran, por lo que todo sigue desequilibrado. Escribe un "2" delante del O2 para representar que tienes que poner dos O2 para obtener lo suficiente de la reacción.
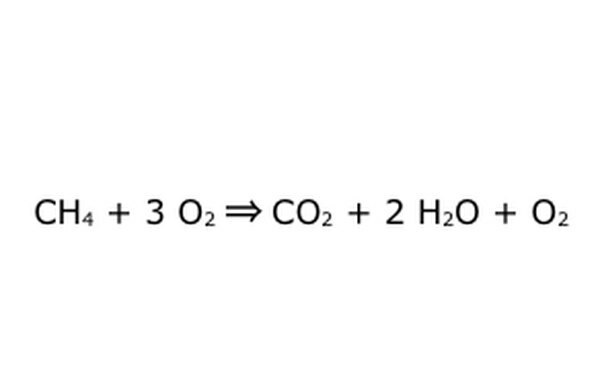
Tenga en cuenta que es posible realizar un proceso como este "con un exceso de oxígeno". Lo que esto significa es que la ecuación introduce más oxígeno del necesario y obtiene más. Por ejemplo, tenga en cuenta que entra un O2 extra, por lo que sale un extra. Solo asegúrese de que la Ley de Conservación se observe en todo momento. Todo lo que entra tiene que salir.
Consejos
Generalmente, las sustancias químicas en este tipo de ecuaciones se miden en moles. Un mol es una unidad que representa 6.0221415 10 ^ (23) moléculas. Como este es un número demasiado grande para comprender, es más fácil pensar en términos de moléculas individuales cuando se realiza el equilibrio. Tenga esto en cuenta al comenzar.
