Las celdas electroquímicas le informan sobre cómo las baterías cargan los circuitos y cómo se alimentan los dispositivos electrónicos como los teléfonos celulares y los relojes digitales. Al examinar la química de las células E, el potencial de las células electroquímicas, encontrará reacciones químicas que las impulsan y envían corriente eléctrica a través de sus circuitos. El potencialmide una célula puede decirle cómo ocurren estas reacciones.
Cálculo de celda E
•••Syed Hussain Ather
Consejos
Manipule las medias reacciones reorganizándolas, multiplicándolas por valores enteros, cambiando el signo del potencial electroquímico y multiplicando el potencial. Asegúrese de seguir las reglas de reducción y oxidación. Sume los potenciales electroquímicos para cada media reacción en una celda para obtener el potencial electroquímico o electromotor total de una celda.
Para calcular elpotencial electromotriz, también conocido como potencial de la fuerza electromotriz (EMF), de ungalvánico, o voltaica, usando la fórmula de la celda E al calcular la celda E:
- Divida la ecuación en medias reacciones si aún no lo ha hecho.
- Determine qué ecuación (es), si corresponde, debe invertirse o multiplicarse por un número entero. Puede determinar esto primero averiguando qué semirreacciones es más probable que ocurran en una reacción espontánea. Cuanto menor sea la magnitud del potencial electroquímico de una reacción, mayor será la probabilidad de que ocurra. Sin embargo, el potencial de reacción general debe seguir siendo positivo.
- Por ejemplo, una media reacción con potencial electroquímico de-.5 Ves más probable que ocurra que uno con potencial1 V.
- Cuando haya determinado qué reacciones es más probable que ocurran, formarán la base de la oxidación y la reducción utilizadas en la reacción electroquímica.
- Cambie las ecuaciones y multiplique ambos lados de las ecuaciones por números enteros hasta que sumen la reacción electroquímica general y los elementos de ambos lados se cancelen. Para cualquier ecuación que cambie, invierta el signo. Para cualquier ecuación que multiplique por un número entero, multiplique el potencial por el mismo número entero.
- Resuma los potenciales electroquímicos de cada reacción teniendo en cuenta los signos negativos.
Puedes recordar el ánodo catódico de la ecuación de la celda E con el mnemónico "Red Cat An Ox" que te dicerojoucción ocurre en elgatohode y elunodabueyidentifica.
Calcule los potenciales de electrodos de las siguientes semiceldas
Por ejemplo, podemos tener una celda galvánica con una fuente de energía eléctrica de CC. Utiliza las siguientes ecuaciones en una batería alcalina AA clásica con los correspondientes potenciales electroquímicos de media reacción. Calcular la celda e es fácil usando elmiecuación de celda para el cátodo y el ánodo.
- MnO2(s) + H2O + e− → MnOOH (s) + OH-(aq); mio= +0,382 V
- Zn (s) + 2 OH -(aq) → Zn (OH)2(s) + 2e-; mio = +1,221 V
En este ejemplo, la primera ecuación describe el agua.H2Osiendo reducido al perder un protón (H+) formarOH- mientras que el óxido de magnesioMnO2se oxida al ganar un protón (H+) para formar óxido-hidróxido de manganesoMnOOH.La segunda ecuación describe el zincZnoxidarse con dos iones de hidróxidoOH - para formar hidróxido de zinc Zn (OH)2 mientras libera dos electrones.
Para formar la ecuación electroquímica general que queremos, primero observe que es más probable que ocurra la ecuación (1) que la ecuación (2) porque tiene una magnitud menor de potencial electroquímico. Esta ecuación es una reducción de agua.H2Opara formar hidróxidoOH-y oxidación de óxido de magnesioMnO2. Esto significa que el proceso correspondiente de la segunda ecuación debe oxidar el hidróxido.OH-para revertirlo de nuevo al aguaH2O.Para lograrlo, debes reducir el hidróxido de zinc.Zn (OH)2de vuelta al zincZn.
Esto significa que la segunda ecuación debe invertirse. Si lo voltea y cambia el signo del potencial electroquímico, obtieneZn (OH)2(s) + 2e- → Zn (s) + 2 OH -(aq) con un potencial electroquímico correspondientemio = -1,221 V.
Antes de sumar las dos ecuaciones, debes multiplicar cada reactivo y producto de la primera ecuación por el entero 2 para asegurarse de que los 2 electrones de la segunda reacción equilibren el único electrón del primero uno. Esto significa que nuestra primera ecuación se convierte en 2MnO2(s) + 2 H2O + 2e− → 2MnOOH (s) + 2OH-(aq)con un potencial electroquímico demio= +0,764 V
Suma estas dos ecuaciones y los dos potenciales electroquímicos para obtener una reacción combinada: 2MnO2(s) + 2 H2O + Zn (OH)2(s) → Zn (s) + MnOOH (s)con potencial electroquímico-0,457 V. Tenga en cuenta que los 2 iones de hidróxido y los 2 electrones en ambos lados se cancelan al crear la fórmula ECell.
Química de la célula E
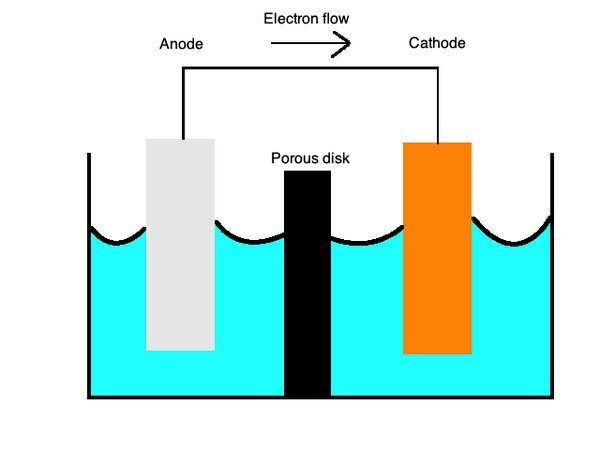
Estas ecuaciones describen los procesos de oxidación y reducción con una membrana semiporosa separada por un puente salino. Lapuente de salestá hecho de un material como el sulfato de potasio que actúa como un electrolito inerte que permite que los iones se difundan por su superficie.
En elcátodos, se produce oxidación, o pérdida de electrones, y, en elánodos, se produce una reducción o ganancia de electrones. Puede recordar esto con la palabra mnemotécnica "OILRIG". Le dice que "Oxidación es pérdida" ("ACEITE") y "Reducción es ganancia" ("RIG"). El electrolito es el líquido que permite que los iones fluyan a través de estas dos partes de la celda.
Recuerde priorizar las ecuaciones y reacciones que tienen más probabilidades de ocurrir porque tienen una magnitud menor de potencial electroquímico. Estas reacciones forman la base de las células galvánicas y todos sus usos, y pueden ocurrir reacciones similares en contextos biológicos. Las membranas celulares generan potencial eléctrico transmembrana a medida que los iones se mueven a través de la membrana y a través de potenciales químicos electromotores.
Por ejemplo, la conversión de dinucleótido de nicotinamida y adenina reducido (NADH) en presencia de protones (H+) y oxígeno molecular (O2) produce su contraparte oxidada (NAD+) junto al agua (H2O) como parte de la cadena de transporte de electrones. Esto ocurre con un protóngradiente electroquímicocausado por el potencial de permitir que la fosforilación oxidativa ocurra en las mitocondrias y produzca energía.
Ecuación de Nernst
LaEcuación de Nernstle permite calcular el potencial electroquímico utilizando las concentraciones de productos y reactivos en equilibrio con el potencial de la celda en voltiosmicélula como
E_ {celda} = E_ {celda} ^ - \ frac {RT} {zF} \ ln {Q}
en el cualmi-célula es el potencial de la semirreacción de reducción,Res la constante universal de los gases (8,31 J x K − 1 mol − 1), Tes la temperatura en grados Kelvin,zes el número de electrones transferidos en la reacción, yQes el cociente de reacción de la reacción global.
El cociente de reacciónQes una relación que involucra concentraciones de productos y reactivos. Para la reacción hipotética:aA + bB ⇌ cC + dDcon reactivosAyB, productosCyDy los valores enteros correspondientesa, B, C, yD, el cociente de reacciónQseríaQ = [C]C[D]D / [A]a[B]Bcon cada valor entre corchetes como la concentración, generalmente enprostituta. Para cualquier ejemplo, la reacción mide esta relación de productos a reactivos.
Potencial de una celda electrolítica
Celdas electrolíticasdifieren de las celdas galvánicas en que utilizan una fuente de batería externa, no el potencial electroquímico natural, para impulsar la electricidad a través del circuito. Puede usar electrodos dentro del electrolito en una reacción no espontánea.
Estas celdas también utilizan un electrolito acuoso o fundido en contraste con el puente salino de las celdas galvánicas. Los electrodos coinciden con el terminal positivo, el ánodo y el terminal negativo, el cátodo, de la batería. Mientras que las celdas galvánicas tienen valores EMF positivos, las celdas electrolíticas tienen valores negativos, lo que significa que, para celdas galvánicas, las reacciones ocurren espontáneamente mientras que las celdas electrolíticas requieren un voltaje externo fuente.
De manera similar a las celdas galvánicas, puede manipular, voltear, multiplicar y agregar las ecuaciones de media reacción para producir la ecuación general de la celda electrolítica.
