Chemický vzorec je zjednodušená standardní notace pro vysvětlení chemické reakce používané v experimentech. Mohou vypadat komplikovaně, ale když se naučíte, jak je číst, stanou se docela vysvětlujícími.
Podívejte se na chemickou reakci, kterou se pokoušíte rozebrat, jako rovnici. Hledejte klíčová slova, konkrétně chemické složky, kterých se to týká. Například metan (CH4) se spaluje, což vždy znamená, že se to děje v kyslíku (O2). Tím se získá jak oxid uhličitý (CO2), tak vodní (H2O) páry. Poznamenejte si umístění slova „Výnosy“, protože je to důležité.
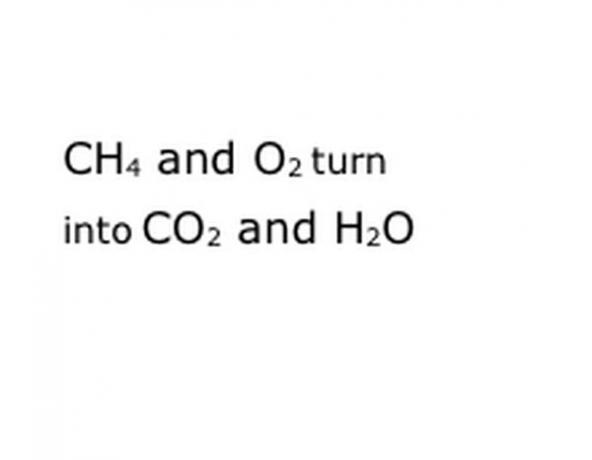
Napište chemické složky reakce ve standardním formátu notace. V našem příkladu to bude CH4, O2, CO2 a H2O. V chemii znamená „výtěžek“ to, že vše, co je předtím, se změní v to, co přijde poté, takže se ujistěte, že „výtěžek“ je zhruba uprostřed. Tato fráze bude představovat skutečnou chemickou reakci, v tomto případě hoření. Takže všechno, co spálíte, musí být před tím a všechno, po čem musí být reakce, musí následovat.
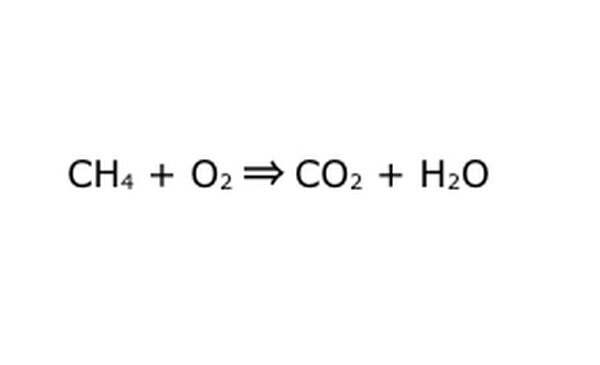
Přepište rovnici jako matematický proces. Nahraďte „výtěžek“ nebo „přeměnu na“ šipkou a nakreslete znaménka plus mezi chemickými složkami. Pro zjednodušení si představte každou chemickou složku jako samostatnou molekulu. Může pomoci nakreslit molekuly na kousek šrotu. Ujistěte se, že všechny molekuly, které jdou dovnitř, jsou zastoupeny. Pokud v konečném produktu něco chybí, můžete to přidat smysluplným způsobem - zkontrolujte cokoli proti tomu, co víte o kovalentní vazbě. Jelikož se většina experimentů provádí v normální atmosféře, můžete v případě potřeby přidat O2 k hořící reakci. Pokud je rovnice reverzibilní, ujistěte se, že má dvojitou šipku, která to představuje.
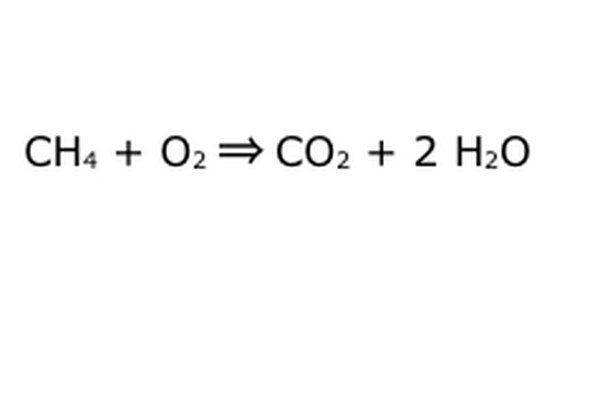
Vyvažte rovnici. Zde vstupuje do hry zákon zachování: myslete na šíp, naši reakci, jako na stroj, do kterého jste vysypali všechny komponenty nalevo. Stroj nevyrábí ani nepřidává nic, co jste nevložili, a proto vyplivne pouze stejné množství věcí, které jste vložili. V tomto přesném okamžiku máme dvě přebytečné molekuly vodíku, které se vznášejí kolem, protože dáte „4“. Jediné místo, které může v tomto stroji jít, je do jednoho z produktů, takže bude muset jít do molekul vody. Napište „2“ před H2O, což znamená, že za každý vložený CH4 dostanete zpět dvě H2O.

Všimněte si, že s naší rovnicí stále existuje malý problém: dovnitř není dostatek kyslíku. Vycházejí čtyři atomy kyslíku, ale vstupují pouze dva, a tak je celá věc stále nevyvážená. Napiš „2“ před O2, což znamená, že musíš dát dva O2, aby bylo z reakce dost.
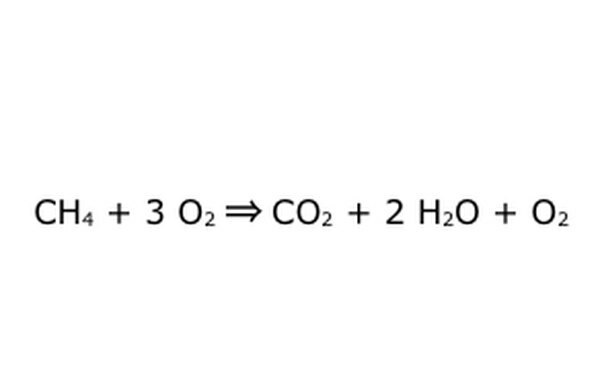
Všimněte si, že je možné udělat takovýto proces „v přebytku kyslíku“. To znamená, že rovnice vloží více kyslíku, než je potřeba, a získá více zpět. Například si všimněte, že vstupuje další O2, takže přichází další. Jen se ujistěte, že je zákon zachování vždy dodržován. Cokoli vstoupí, musí vyjít.
Tipy
Obecně se chemikálie v těchto typech rovnic měří v molech. Mole je jednotka, která představuje 6,0221415 10 ^ (23) molekul. Jelikož je toto číslo příliš velké na to, aby ho bylo možné pochopit, je snazší při vyvážení myslet na jednotlivé molekuly. Uvědomte si to při spuštění.
