Вероятно сте се сблъсквали с батерии, които се изпразват, което е неприятно, ако се опитвате да ги използвате в електронни устройства. Клетъчната химия на батериите може да ви покаже свойствата на това как работят, включително как се разпадат.
Клетъчна химия на батериите
•••Syed Hussain Ather
Когато електрохимичната реакция на батерията изтощава материалите, батерията се изпразва. Това обикновено се случва след дълго време на използване на батерията.
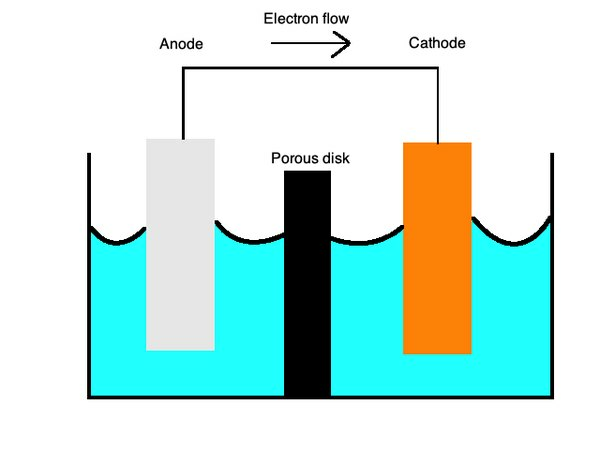
Батериите обикновено използват първични клетки, типгалванична клеткакойто използва два различни метала в течен електролит, за да позволи прехвърлянето на заряд между тях. Положителните заряди текат откатод, изградени с катиони или положително заредени йони като мед, къманод, с аниони или отрицателно заредени йони като цинк.
Съвети
Батериите се изпразват в резултат на изсъхването на химикалите на електролита в батерията. При алкалните батерии това е, когато целият манганов диоксид е преобразуван. На този етап батерията е изтощена.
За да запомните тази връзка, можете да си спомните думата "OILRIG." Това ви казва това
Първичните клетки могат да работят и с отделни полуклетъци от различни метали в йонен разтвор, свързан чрез солен мост или пореста мембрана. Тези клетки осигуряват безброй приложения на батериите.
Алкални батерии, които специално използват реакцията между цинков анод и магнезиев катод, се използват за фенерчета, преносими електронни устройства и дистанционни управления. Други примери за популярни елементи на батерията включват литий, живак, силиций, сребърен оксид, хромова киселина и въглерод.
Инженерните проекти могат да се възползват от начина, по който батериите се разпадат, за да запазят и използват отново енергията. Евтините битови батерии обикновено използват въглерод-цинкови клетки, проектирани така, че ако цинкът претърпигалванична корозия, процес, при който металът корозира за предпочитане, батерията може да произвежда електричество като част от затворена електронна верига.
При каква температура експлодират батериите? Химията на клетките на литиево-йонните батерии означава, че тези батерии започват химически реакции, които водят до експлозията им при около 1000 ° C. Медният материал вътре в тях се топи, което води до счупване на вътрешните ядра.
История на химическата клетка
През 1836 г. британският химик Джон Фредерик Даниел конструираКлетка на Даниелв който той използва два електролита, вместо само един, за да позволи на водорода, произведен от единия, да бъде изразходван от другия. Той използва цинков сулфат вместо сярна киселина, обичайна практика на батериите от онова време.
Преди това учените са използвали волтови клетки, вид химическа клетка, която използва спонтанна реакция, която губи мощност с бързи темпове. Daniell използва бариера между медната и цинковата плоча, за да предотврати излишното изпускане на водород и да спре батерията от бързо износване. Неговата работа ще доведе до иновации в телеграфията и електрометалургията, методът за използване на електрическа енергия за производство на метали.
Как се зареждат акумулаторните батерии
Вторични клетки, от друга страна, са акумулаторни. Акумулаторната батерия, наричана още акумулаторна батерия, вторична клетка или акумулатор, съхранява зареждането във времето, тъй като катодът и анодът са свързани във верига един с друг.
При зареждане положителният активен метал като никелов оксид хидроксид се окислява, създавайки електрони и ги губи, докато отрицателният материал като кадмий се редуцира, улавяйки електрони и получавайки тях. Батерията използва цикли на зареждане-разреждане, като използва различни източници, включително променлив ток като външен източник на напрежение.
Акумулаторните батерии все още могат да се изправят след многократна употреба, защото материалите, участващи в реакцията, губят способността си да се зареждат и презареждат. Тъй като тези батерийни системи се износват, има различни начини батериите да се изправят.
Тъй като батериите се използват рутинно, някои от тях като оловно-киселинните батерии могат да загубят способността да се презареждат. Литийът на литиево-йонните батерии може да се превърне в реактивен литиев метал, който не може да влезе отново в цикъла на зареждане и разреждане. Батериите с течни електролити могат да намалят влагата си поради изпаряване или презареждане.
Приложения на акумулаторни батерии
Тези батерии обикновено се използват в автомобилни стартери, инвалидни колички, електрически велосипеди, електрически инструменти и електроцентрали за съхранение на батерии. Учени и инженери са проучили тяхното използване в хибридни акумулатори с вътрешно горене и електрически превозни средства, за да станат по-ефективни при тяхното използване на енергия и да продължат по-дълго.
Акумулаторната оловно-киселинна батерия разбива молекулите на водата (Н2О) във воден разтвор на водород (Н+) и оксидни йони (О2-), който произвежда електрическа енергия от скъсаната връзка, тъй като водата губи своя заряд. Когато водният разтвор на водород реагира с тези оксидни йони, силните O-H връзки се използват за захранване на батерията.
Физика на реакциите на батерията
Тази химическа енергия задвижва окислително-възстановителна реакция, която превръща високоенергийните реактиви в продукти с по-ниска енергия. Разликата между реагентите и продуктите позволява реакцията да се случи и образува електрическа верига, когато батерията е свързана чрез преобразуване на химическата енергия в електрическа енергия.
В галванична клетка реагентите, като метален цинк, имат висока свободна енергия, която позволява реакцията да протича спонтанно без външна сила.
Металите, използвани в анода и катода, имат решетъчно кохезионни енергии, които могат да задвижат химическата реакция. Решетъчната кохезионна енергия е енергията, необходима за разделяне на атомите, които правят метала един от друг. Често се използват метален цинк, кадмий, литий и натрий, тъй като те имат високи енергии на йонизация, минималната енергия, необходима за отстраняване на електроните от даден елемент.
Галваничните клетки, задвижвани от йони от същия метал, могат да използват разлики в свободната енергия, за да накарат свободната енергия на Гибс да задейства реакцията. TheБезплатна енергия на Гибсе друга форма на енергия, използвана за изчисляване на количеството работа, която използва термодинамичният процес.
В този случай промяната в стандартната свободна енергия на ГибсGo задвижва напрежението или електродвижещата силаЕ.oвъв волта, според уравнението
E ^ {\ text {o}} = \ frac {- \ Delta_rG ^ {\ text {o}}} {v_eF}
в койтоvде броят на електроните, прехвърлени по време на реакцията и F е константата на Фарадей (F = 96485,33 С мол−1).
TheΔrGo показва, че уравнението използва промяната в свободната енергия на Гибс (ΔrGo =Gфинал - Gпървоначална).Ентропията се увеличава, тъй като реакцията използва наличната свободна енергия. В клетката на Даниел разликата в енергията на кохезионната кохезивна решетка между цинк и мед отчита по-голямата част от разликата в свободната енергия на Гибс, когато реакцията настъпи.ΔrGo= -213 kJ / mol, което е разликата в свободната енергия на Гибс на продуктите и тази на реагентите.
Напрежение на галванична клетка
Ако разделите електрохимичната реакция на галваничен елемент на половината реакции на окисление и редукция процеси, можете да сумирате съответните електромоторни сили, за да получите общата разлика в напрежението, използвана в клетка.
Например, типичен галваничен елемент може да използва CuSO4 и ZnSO4 със стандартни потенциални половин реакции като:Cu2+ + 2 д− ⇌ Cuсъс съответстващ електромоторен потенциалЕ.o = +0,34 VиZn2+ + 2 д− ⇌ Znс потенциалЕ.o = -0,76 V.
За цялостната реакция,Cu2+ + Zn ⇌ Cu + Zn2+ , можете да "обърнете" уравнението на половината реакция за цинк, докато обръщате знака на електромоторната сила, за да получитеZn ⇌ Zn2+ + 2 д− сЕ.o = 0,76 V.Тогава общият потенциал на реакцията, сумата от електромоторните сили, е+0,34 V - (−0,76 V) = 1,10 V.
