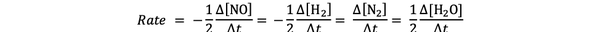علم الحركة هو فرع الكيمياء الفيزيائية الذي يدرس معدل التفاعلات الكيميائية. في المقابل ، تخبرنا الديناميكا الحرارية عن اتجاه التفاعل المفضل ، دون الكشف عن معدل التفاعل. يمكن تفضيل بعض التفاعلات من الناحية الديناميكية الحرارية ولكنها غير مفضلة من الناحية الحركية.
على سبيل المثال ، في تحويل الماس إلى جرافيت ، يكون للجرافيت طاقة حرة أقل من الماس ، لذلك يفضل التحويل الديناميكي الحراري. ومع ذلك ، هناك حاجز تنشيط كبير للماس لكسر وإصلاح جميع الروابط إلى المزيد تكوين الجرافيت المستقر ، وبالتالي فإن هذا التفاعل غير مرغوب فيه من الناحية الحركية ولن يحدث بالفعل.
نسبة التفاعل
ال نسبة التفاعل هو مقياس لمدى سرعة تكوين المنتجات والمواد المتفاعلة التي يتم استهلاكها ، لذلك يمكنك تحديد ذلك عن طريق قياس التغيير في تركيز المنتجات أو المتفاعلات ، على مدار فترة زمنية. ضع في اعتبارك تفاعل كيميائي عام:
aA + bB> cC + dD
يمكن كتابة معدل التفاعل على النحو التالي:

•••تم التعديل من https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
على سبيل المثال معدل التفاعل لـ:
2 لا (ز) + 2 ح2 (ز)> ن2(ز) + 2 ح2يا (ز)
اعطي من قبل

•••مقتبس من https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
لتحديد معدل رد الفعل هذا بالتجربة ، يمكنك قياس تركيز H2 في أوقات مختلفة من التفاعل ، وقم برسمه مقابل الوقت على النحو التالي:

•••تم التعديل من https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates

•••تم التعديل من https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
ال متوسط معدل التفاعل هو تقريب لمعدل التفاعل في فترة زمنية ويمكن الإشارة إليه من خلال:

•••تم التعديل من https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
ال معدل التفاعل الفوري يتم تعريفه على أنه معدل التفاعل في لحظة ما في الوقت المناسب. إنه معدل تفاضلي ويمكن التعبير عنه من خلال:

•••تم التعديل من https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
أين د [ح2] / dt هو منحدر منحنى تركيز H2 مقابل الوقت في الوقت t.
ال المعدل الأولي للتفاعل هو المعدل اللحظي في بداية التفاعل ، عندما يكون t = 0. في هذه الحالة ، فإن ملف وحدة لمعدل التفاعل المتوسط واللحظية والبدئي هو M / s.
قانون معدل
في معظم الحالات ، يعتمد معدل التفاعل على تركيز المواد المتفاعلة المختلفة في الوقت t. على سبيل المثال ، عند وجود تركيز أعلى لجميع المواد المتفاعلة ، تتصادم المواد المتفاعلة بشكل متكرر وتؤدي إلى تفاعل أسرع. يتم تعريف العلاقة بين معدل التفاعل ν (t) والتركيزات على أنها قانون معدل. وقانون المعدل للتفاعل الكيميائي العام aA + bB> cC + dD هو:

•••تم التعديل من https://chem.libretexts.org/Bookshelves/Ancillary_Materials/Laboratory_Experiments/Wet_Lab_Experiments/General_Chemistry_Labs/Online_Chemistry_Lab_Manual/Chem_12_Experiments/01%3A_Chemical_Kinetics_-_The_Method_of_Initial_Rates_(Experiment)
حيث k هو ثابت المعدل ، والقوة x و y هي ترتيب من التفاعل فيما يتعلق بالمتفاعل A و B. يجب تحديد قانون المعدل تجريبيًا ولا يمكن استنتاجه من مجرد القياس المتكافئ لتفاعل كيميائي متوازن.
طريقة الأسعار الأولية
يمكن تحديد قانون المعدل بواسطة طريقة المعدلات الأولية. في هذه الطريقة ، يتم إجراء التجربة عدة مرات ، مع تغيير تركيز متفاعل واحد فقط لكل شوط مع الحفاظ على المتغيرات الأخرى ثابتة. يتم قياس معدل التفاعل لكل شوط لتحديد ترتيب كل متفاعل في قانون المعدل.
على سبيل المثال ، ضع في اعتبارك بيانات المعدل الأولية التالية للتفاعل:
2 لا (ز) + 2 ح2 (ز)> ن2(ز) + 2 ح2يا (ز)

•••مقتبس من https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
للتجربة 1 و 3 ، يظل تركيز NO ثابتًا بينما تركيز H22 يتضاعف. نتيجة لذلك ، تضاعف أيضًا معدل التفاعل الأولي (فكر في الأمر على أنه 21) ، لذا يمكنك استنتاج ص = 1. للتجربة 1 و 2 ، يتضاعف تركيز NO بينما تركيز H22 يبقى ثابتا. نتيجة هذا التغيير هو أن المعدل الأولي تضاعف أربع مرات (فكر في الأمر على أنه 22). لذلك يمكنك استنتاج أن x = 2.
لذلك فإن قانون معدل هذا التفاعل هو:

•••مقتبس من https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
ورد الفعل الطلب الأول في H.2 و الدرجة الثانية في NO.