Ви, мабуть, стикалися з розрядженими акумуляторами, що неприємно, якщо ви намагаєтеся використовувати їх в електроніці. Клітична хімія батарей може сказати вам властивості того, як вони працюють, включаючи те, як вони розряджаються.
Клітинна хімія акумуляторів
•••Саєд Хуссейн Атер
Коли електрохімічна реакція батареї виснажує матеріали, батарея розряджається. Зазвичай це відбувається після тривалого використання акумулятора.
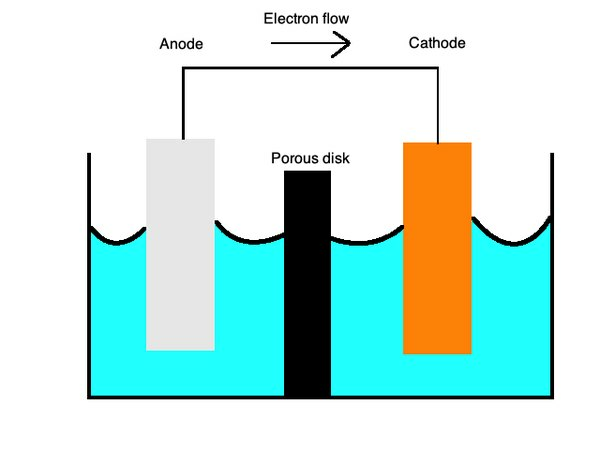
Акумулятори зазвичай використовують первинні елементи, типгальванічний елементякий використовує два різні метали в рідкому електроліті, щоб забезпечити перенесення заряду між ними. Позитивні заряди випливають зкатод, побудований катіонами або позитивно зарядженими іонами, такими як мідь, доанод, з аніонами або негативно зарядженими іонами, такими як цинк.
Поради
Батареї розряджаються в результаті висихання хімічних речовин електроліту в батареї. У випадку з лужними батареями це коли перетворюється весь діоксид марганцю. На цьому етапі батарея розряджена.
Щоб запам'ятати ці стосунки, ви можете згадати слово "OILRIG". Це вам це говорить
Первинні клітини можуть також працювати з окремими напівклітинами різних металів в іонному розчині, з'єднаному сольовим містком або пористою мембраною. Ці елементи забезпечують безліч способів використання акумуляторів.
Лужні батареї, які спеціально використовують реакцію між цинковим анодом та магнієвим катодом, використовуються для ліхтариків, портативних електронних пристроїв та пультів дистанційного керування. Інші приклади популярних елементів батареї включають літій, ртуть, кремній, оксид срібла, хромову кислоту та вуглець.
Інженерні конструкції можуть використовувати переваги того, як акумулятори розряджаються, для збереження та повторного використання енергії. У дешевих побутових акумуляторах зазвичай використовуються вуглецево-цинкові елементи, сконструйовані таким чином, що, якщо цинк зазнає впливугальванічна корозія, процес, при якому метал переважно піддається корозії, акумулятор може виробляти електроенергію як частину замкнутого електронного кола.
При якій температурі вибухають батареї? Хімія клітин літій-іонних батарей означає, що ці батареї починають хімічні реакції, що призводять до їх вибуху приблизно при 1000 ° C. Мідний матеріал усередині них плавиться, що призводить до розриву внутрішніх сердечників.
Історія хімічної клітини
У 1836 році британський хімік Джон Фредерік Даніелл сконструювавКлітина Даніеляв якому він використовував два електроліти, замість одного, щоб дозволити водню, виробленому одним, споживати іншому. Він використовував сульфат цинку замість сірчаної кислоти, звичайна практика батарей того часу.
До цього вчені використовували вольтаїчні клітини - тип хімічної клітини, яка використовує спонтанну реакцію, яка швидко втрачала потужність. Даніелл використовував бар'єр між мідною та цинковою пластинами, щоб запобігти бурхленню надлишку водню та зупинити швидкий знос батареї. Його робота призведе до нововведень у телеграфії та електрометалургії, способі використання електричної енергії для виробництва металів.
Як перезаряджаються акумулятори
Вторинні клітини, з іншого боку, є акумуляторними. Акумуляторна батарея, яку також називають акумуляторною батареєю, вторинним елементом або акумулятором, зберігає заряд з часом, оскільки катод і анод з'єднані в ланцюг один з одним.
Під час заряджання позитивний активний метал, такий як гідроксид оксиду нікелю, окислюється, створюючи електрони і втрачаючи їх, тоді як негативний матеріал, такий як кадмій, зменшується, захоплюючи електрони і отримуючи їх. Акумулятор використовує цикли зарядки-розрядки, використовуючи різні джерела, включаючи електрику змінного струму як зовнішнє джерело напруги.
Акумуляторні батареї все ще можуть розряджатися після багаторазового використання, оскільки матеріали, що беруть участь у реакції, втрачають здатність заряджатися та перезаряджатися. Оскільки ці акумуляторні системи зношуються, існують різні способи розряду батарей.
Оскільки батареї використовуються регулярно, деякі з них, такі як свинцево-кислотні акумулятори, можуть втратити здатність до зарядки. Літій літій-іонних батарей може стати реактивним металом літію, який не може знову вступити в цикл заряду-розряду. Батареї з рідкими електролітами можуть зменшувати свою вологу внаслідок випаровування або перезарядки.
Застосування акумуляторних батарей
Ці батареї, як правило, використовуються в автомобільних стартерах, інвалідних візках, електричних велосипедах, електроінструментах та електростанціях для зберігання акумуляторів. Вчені та інженери вивчили їх використання в гібридних акумуляторах внутрішнього згоряння та електричних транспортних засобах, щоб стати більш ефективними у своєму енергоспоживанні та довше служити.
Акумуляторна свинцево-кислотна батарея розбиває молекули води (H2О) у водний розчин водню (H+) і оксид-іони (О2-), який виробляє електричну енергію з розірваного зв’язку, оскільки вода втрачає заряд. Коли водний розчин водню вступає в реакцію з цими оксидними іонами, для живлення акумулятора використовуються міцні зв’язки O-H.
Фізика реакцій акумулятора
Ця хімічна енергія забезпечує окислювально-відновну реакцію, яка перетворює високоенергетичні реактиви в продукти з нижчою енергією. Різниця між реагентами та продуктами дозволяє реакції відбуватися і утворює електричний ланцюг, коли акумулятор підключається шляхом перетворення хімічної енергії в електричну.
У гальванічному елементі реагенти, такі як металевий цинк, мають високу вільну енергію, що дозволяє реакції відбуватися спонтанно без зовнішньої сили.
Метали, що використовуються в аноді та катоді, мають енергію когезійної решітки, яка може викликати хімічну реакцію. Когезивна енергія решітки - це енергія, необхідна для відокремлення атомів, що утворюють метал, один від одного. Металевий цинк, кадмій, літій та натрій часто використовують, оскільки вони мають високі енергії іонізації, мінімальну енергію, необхідну для видалення електронів з елемента.
Гальванічні елементи, керовані іонами того самого металу, можуть використовувати різницю у вільній енергії, щоб змусити Гіббса вільною енергією рухати реакцію.Безкоштовна енергія Гіббсаце інша форма енергії, що використовується для обчислення обсягу роботи, яку використовує термодинамічний процес.
У цьому випадку відбувається зміна стандартної вільної енергії ГіббсаGo керує напругою або електрорушійною силоюЕoу вольтах, згідно з рівнянням
E ^ {\ text {o}} = \ frac {- \ Delta_rG ^ {\ text {o}}} {v_eF}
в якійve- кількість електронів, що передаються під час реакції, а F - постійна Фарадея (F = 96485,33 С моль−1).
ΔрGo вказує, що в рівнянні використовується зміна вільної енергії Гіббса (ΔрGo =Gостаточний - Gпочатковий).Ентропія зростає, оскільки реакція використовує наявну вільну енергію. У клітині Даніелла різниця енергій когезійної решітки між цинком і міддю становить більшу частину різниці вільних енергій Гіббса в процесі реакції.ΔрGo= -213 кДж / моль, що є різницею у вільній енергії Гіббса продуктів та енергії реагентів.
Напруга гальванічного елемента
Якщо розділити електрохімічну реакцію гальванічного елемента на половину реакцій окислення та відновлення процесів, можна підсумувати відповідні електрорушійні сили, щоб отримати загальну різницю напруг, що використовується в клітинку.
Наприклад, типовий гальванічний елемент може використовувати CuSO4 і ZnSO4 зі стандартними потенційними напівреакціями як:Cu2+ + 2 е− ⇌ Cuз відповідним електрорушійним потенціаломЕo = +0,34 ВіZn2+ + 2 е− ⇌ Znз потенціаломЕo = -0,76 В.
Для загальної реакції,Cu2+ + Zn ⇌ Cu + Zn2+ , ви можете "перевернути" рівняння напівреакції на цинк, перевертаючи знак електрорушійної сили, щоб отриматиZn ⇌ Zn2+ + 2 е− зЕo = 0,76 В.Тоді загальний потенціал реакції, сума електрорушійних сил, становить+0,34 В - (−0,76 В) = 1,10 В.
