Kimyasal formül, deneylerde kullanılan bir kimyasal reaksiyonu açıklamak için basitleştirilmiş, standart bir gösterimdir. Karmaşık görünebilirler, ancak onları nasıl okuyacağınızı öğrendiğinizde, oldukça açıklayıcı hale gelirler.
Bir denklem olarak çözmeye çalıştığınız kimyasal reaksiyona bakın. Anahtar kelimeleri, özellikle ilgili kimyasal bileşenleri arayın. Örneğin metan (CH4) yanar, bu da her zaman oksijende (O2) yapıldığı anlamına gelir. Bu hem karbondioksit (CO2) hem de su (H2O) buharı verir. Önemli olduğu için "Verimler" kelimesinin yerini not edin.
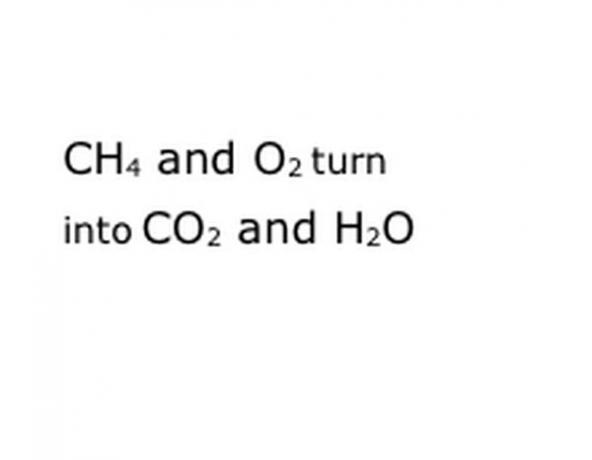
Reaksiyonun kimyasal bileşenlerini standart gösterim formatında yazın. Örneğimizde bu CH4, O2, CO2 ve H2O olacaktır. Kimyada "verim" demek, önce olanın sonra gelene dönüşmesi anlamına gelir, bu yüzden "verim"in kabaca ortada olduğundan emin olun. Bu ifade, gerçek kimyasal reaksiyonu, bu durumda yanmayı temsil edecektir. Yani yakacağınız her şey ondan önce olmalı ve reaksiyonun verdiği her şey ondan sonra olmalıdır.
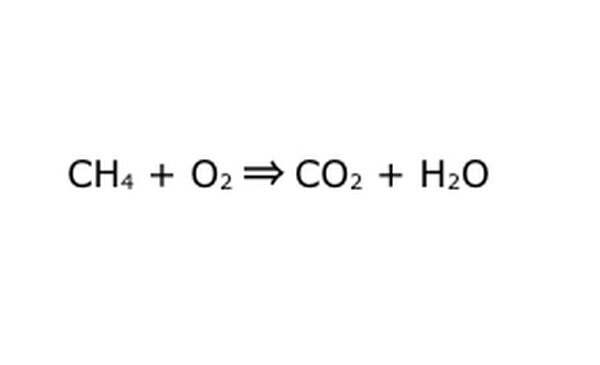
Denklemi matematiksel bir işlem olarak yeniden yazın. "Verim" veya "dönüşler" yerine bir ok koyun ve kimyasal bileşenler arasına artı işaretleri çizin. İşleri basitleştirmek için, her kimyasal bileşeni ayrı bir molekül olarak düşünün. Molekülleri bir parça kağıt üzerine çekmek yardımcı olabilir. İçeri giren tüm moleküllerin dışarı çıkarken temsil edildiğinden emin olun. Nihai üründe eksik bir şey varsa, bunu mantıklı bir şekilde ekleyebilirsiniz - kovalent bağ hakkında bildiklerinize karşı her şeyi kontrol edin. Çoğu deney normal atmosferde yapıldığından, gerekirse yanma reaksiyonlarına O2 ekleyebilirsiniz. Denklem tersine çevrilebilirse, bunu temsil eden bir çift ok olduğundan emin olun.
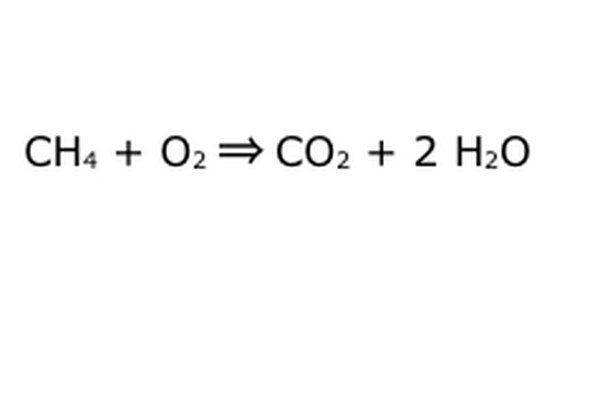
Denklemini dengele. Koruma Yasasının devreye girdiği yer burasıdır: Oku, tepkimizi, soldaki tüm bileşenleri içine attığınız bir makine olarak düşünün. Makine sizin koymadığınız hiçbir şeyi yapmaz veya eklemez ve bu nedenle yalnızca sizin koyduğunuz miktarda malzemeyi dışarı tükürür. Tam bu anda, "4" girdiğiniz için etrafta yüzen iki fazla hidrojen molekülü var. Bu makinede gidebileceği tek yer ürünlerden birinin içine giriyor, bu yüzden su moleküllerinin içine girmesi gerekecek. Girdiğiniz her CH4 için iki H2O geri alacağınızı belirtmek için H2O'nun önüne bir "2" yazın.

Denklemimizde hala küçük bir sorun olduğuna dikkat edin: içeri giren yeterli oksijen yok. Dışarı çıkan dört oksijen atomu var ama sadece ikisi giriyor ve bu yüzden her şey hala dengesiz. Reaksiyondan yeterince yararlanmak için iki O2 koymanız gerektiğini göstermek için O2'nin önüne bir "2" yazın.
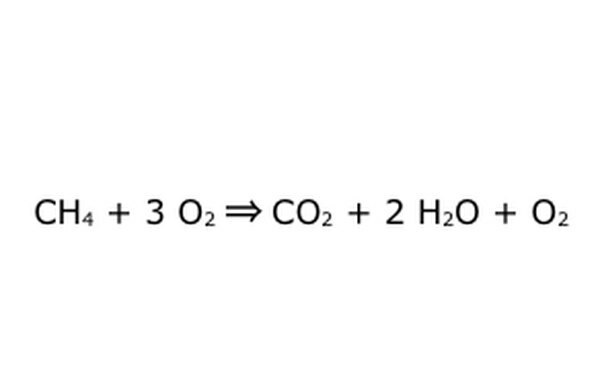
"Aşırı Oksijende" böyle bir işlem yapmanın mümkün olduğunu unutmayın. Bunun anlamı, denklem gerekenden daha fazla oksijen koyar ve daha fazlasını geri alır. Örnek için, fazladan bir O2 girdiğine, dolayısıyla fazladan bir dışarı çıktığına dikkat edin. Sadece Koruma Yasasına her zaman uyulduğundan emin olun. İçeri giren her şey dışarı çıkmak zorunda.
İpuçları
Genellikle bu tür denklemlerdeki kimyasallar mol cinsinden ölçülür. Bir mol, 6.0221415 10^(23) molekülü temsil eden bir birimdir. Bu, kavranamayacak kadar büyük bir sayı olduğundan, dengelenirken tek moleküller açısından düşünmek daha kolaydır. Başlarken bunun farkında olun.
