Elektrokemiska celler berättar om hur batterier laddar kretsar och hur elektroniska enheter som mobiltelefoner och digitala klockor drivs. När du tittar på E-cellkemi, potentialen hos elektrokemiska celler, hittar du kemiska reaktioner som driver dem som skickar elektrisk ström genom sina kretsar. PotentialenEi en cell kan berätta hur dessa reaktioner uppstår.
Beräkning av E-cell
•••Syed Hussain Ather
Tips
Manipulera halvreaktionerna genom att ordna om dem, multiplicera dem med helvärden, vända tecknet på den elektrokemiska potentialen och multiplicera potentialen. Se till att du följer reglerna för reduktion och oxidation. Sammanfatta de elektrokemiska potentialerna för varje halvreaktion i en cell för att få den totala elektrokemiska eller elektromotoriska potentialen för en cell.
För att beräknaelektromotorisk potential, även känd som den elektromotoriska kraftens potential (EMF), av engalvaniskeller voltaisk cell med E-cellformeln vid beräkning av E-cell:
- Dela ekvationen i halva reaktioner om den inte redan är det.
- Bestäm vilken eller vilka ekvationer som måste vändas eller multipliceras med ett heltal. Du kan bestämma detta genom att först ta reda på vilka halva reaktioner som mest sannolikt kommer att inträffa i en spontan reaktion. Ju mindre storleken på den elektrokemiska potentialen för en reaktion, desto mer sannolikt är det. Den totala reaktionspotentialen måste dock förbli positiv.
- Till exempel en halvreaktion med elektrokemisk potential på-.5 Vär mer sannolikt att inträffa än en med potential1 V.
- När du har bestämt vilka reaktioner som är mest troliga kommer de att ligga till grund för den oxidation och reduktion som används i den elektrokemiska reaktionen.
- Vänd ekvationer och multiplicera båda sidor av ekvationer med heltal tills de sammanfattar den totala elektrokemiska reaktionen och elementen på båda sidor avbryts. För varje ekvation som du vänder, vänd tecknet. För varje ekvation du multiplicerar med ett heltal, multiplicera potentialen med samma heltal.
- Sammanfatta de elektrokemiska potentialerna för varje reaktion med hänsyn till negativa tecken.
Du kommer ihåg E-cellens ekodekatodanod med den mnemoniska "Red Cat An Ox" som talar om för digrödfunktion uppträder vidkatthode ochettodeoxeidiserar.
Beräkna elektrodpotentialerna för följande halvceller
Vi kan till exempel ha en galvanisk cell med en likströmskälla. Den använder följande ekvationer i ett klassiskt AA alkaliskt batteri med motsvarande halvreaktion elektrokemiska potentialer. Det är enkelt att beräkna e-cellen medEcellekvation för katoden och anoden.
- MnO2(s) + H2O + e− → MnOOH (s) + OH-(aq); Eo= +0,382 V
- Zn (s) + 2OH -(aq) → Zn (OH)2(s) + 2e-; Eo = +1,211 V
I detta exempel beskriver den första ekvationen vattenH2Ominskas genom att förlora en proton (H+) att formaÅH- medan magnesiumoxidMnO2oxideras genom att få en proton (H+till bildning av manganoxid-hydroxidMnOOH.Den andra ekvationen beskriver zinkZnblir oxiderad med två hydroxidjonerÅH - för att bilda zinkhydroxid Zn (OH)2 medan du släpper ut två elektroner.
För att bilda den övergripande elektrokemiska ekvationen vi vill ha, noterar du först att ekvation (1) är mer sannolikt att förekomma än ekvation (2) eftersom den har lägre elektrokemisk potential. Denna ekvation är en minskning av vattenH2Oför att bilda hydroxidÅH-och oxidation av magnesiumoxidMnO2. Detta betyder att motsvarande process i den andra ekvationen måste oxidera hydroxidÅH-för att återställa den till vattenH2O.För att uppnå detta måste du minska zinkhydroxidZn (OH)2tillbaka till zinkZn.
Det betyder att den andra ekvationen måste vändas. Om du vänder på det och ändrar tecken på den elektrokemiska potentialen, får duZn (OH)2(s) + 2e- → Zn (s) + 2OH -(aq) med motsvarande elektrokemisk potentialEo = -1,221 V.
Innan du summerar de två ekvationerna tillsammans måste du multiplicera varje reaktant och produkt av den första ekvationen med heltalet 2 för att se till att de 2 elektronerna i den andra reaktionen balanserar ut den enskilda elektronen från den första ett. Det betyder att vår första ekvation blir 2MnO2(s) + 2 H2O + 2e− → 2MnOOH (s) + 2OH-(aq)med en elektrokemisk potential avEo= +0,764 V
Lägg till dessa två ekvationer tillsammans och de två elektrokemiska potentialerna tillsammans för att få en kombinerad reaktion: 2MnO2(s) + 2 H2O + Zn (OH)2(s) → Zn (s) + MnOOH (s)med elektrokemisk potential-0,457 V. Observera att de 2 hydroxidjonerna och de 2 elektronerna på båda sidor avbryts när ECell-formeln skapas.
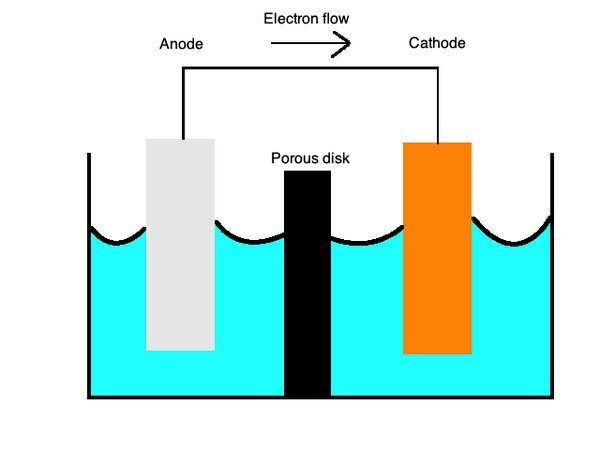
E Cellkemi
Dessa ekvationer beskriver oxidations- och reduktionsprocesserna med ett halvporöst membran åtskilt av en saltbrygga. Desaltbroär tillverkat av ett material som kaliumsulfat som fungerar som n inert elektrolyt som låter jonen diffundera över dess yta.
Vidkatoder, oxidation eller förlust av elektroner, inträffar och, vidanoder, minskning eller förstärkning av elektroner inträffar. Du kan komma ihåg detta med det mnemoniska ordet "OILRIG." Den säger att "Oxidation Is Loss" ("OIL") och "Reduction Is Gain" ("RIG"). Elektrolyten är vätskan som låter joner flöda genom båda dessa delar av cellen.
Kom ihåg att prioritera ekvationer och reaktioner som är mer benägna att inträffa eftersom de har en lägre storlek på elektrokemisk potential. Dessa reaktioner utgör grunden för galvaniska celler och all deras användning, och liknande reaktioner kan förekomma i biologiska sammanhang. Cellmembran genererar transmembran elektrisk potential när joner rör sig över membranet och genom elektromotoriska kemiska potentialer.
Omvandlingen av reducerad nikotinamidadenindinukleotid (t.ex.NADH) i närvaro protoner (H+) och molekylärt syre (O2) producerar sin oxiderade motsvarighet (NAD+) vid sidan av vatten (H2O) som en del av elektrontransportkedjan. Detta inträffar med ett protonelektrokemisk lutningorsakad av potentialen att låta oxidativ fosforylering inträffa i mitokondrier och producera energi.
Nernst ekvation
DeNernst ekvationlåter dig beräkna den elektrokemiska potentialen med hjälp av koncentrationerna av produkter och reaktanter vid jämvikt med cellpotential i voltEcell som
E_ {cell} = E_ {cell} ^ - \ frac {RT} {zF} \ ln {Q}
i vilkenE-cell är potentialen för reduktionshalvreaktionen,Rär den universella gaskonstanten (8,31 J x K − 1 mol − 1), Tär temperaturen i Kelvins,zär antalet elektroner som överförs i reaktionen, ochFär reaktionskvoten för den totala reaktionen.
ReaktionskvotenFär ett förhållande som involverar koncentrationer av produkter och reaktanter. För den hypotetiska reaktionen:aA + bB ⇌ cC + dDmed reaktanterAochB, ProdukterCochDoch motsvarande heltalsvärdena, b, cochd, reaktionskvotenFskulle varaQ = [C]c[D]d / [A]a[B]bmed varje parentesvärde som koncentration, vanligtvis imol / L.. För varje exempel mäter reaktionen denna ration av produkter till reaktanter.
Potentialen hos en elektrolytisk cell
Elektrolytiska cellerskiljer sig från galvaniska celler genom att de använder en extern batterikälla, inte den naturliga elektrokemiska potentialen, för att driva elektricitet genom kretsen. kan använda elektroder inuti elektrolyten i en icke-spontan reaktion.
Dessa celler använder också en vattenhaltig eller smält elektrolyt i motsats till saltbryggan av galvaniska celler. Elektroderna matchar batteriets positiva terminal, anoden och negativa terminalen, katoden. Medan galvaniska celler har positiva EMF-värden, har elektrolytiska celler negativa, vilket betyder att, för galvaniska celler uppstår reaktionerna spontant medan elektrolytiska celler kräver en extern spänning källa.
På samma sätt som de galvaniska cellerna kan du manipulera, vända, multiplicera och lägga till halvreaktionsekvationerna för att producera den totala elektrolytiska cellekvationen.
