Кинетика је грана физичке хемије која проучава брзину хемијских реакција. Супротно томе, термодинамика нам говори у ком правцу реакције се преферира, не откривајући њену брзину реакције. Неке реакције могу бити термодинамички наклоњене, али кинетички неповољне.
На пример, у конверзији дијаманта у графит, графит има нижу слободну енергију од дијаманта, па је конверзија термодинамички фаворизована. Међутим, постоји велика препрека за активирање да дијамант разбије и реформише све везе на више стабилна графитна конфигурација, па је ова реакција кинетички неповољна и заправо се неће догодити.
Стопа реакције
Тхе брзина реакције је мера брзине стварања производа и потрошње реактаната, па га можете одредити мерењем промене концентрације производа или реактаната током одређеног временског периода. Размотримо општу хемијску реакцију:
аА + бБ> цЦ + дД
Брзина реакције може се записати као:
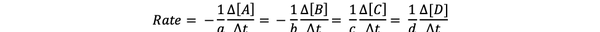
•••Измењено из https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
На пример, брзина реакције за:
2 НЕ (г) + 2 Х.2 (г)> Н.2(г) + 2Х2О (г)
даје
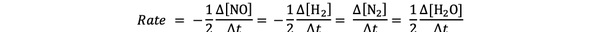
•••Адаптиран од https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
Да бисте експериментом утврдили брзину ове реакције, можете измерити концентрацију Х2 у различито време реакције и распоредите је према времену на следећи начин:
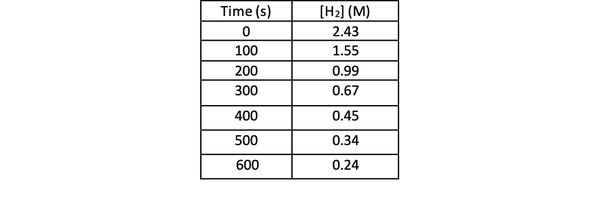
•••Измењено из https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
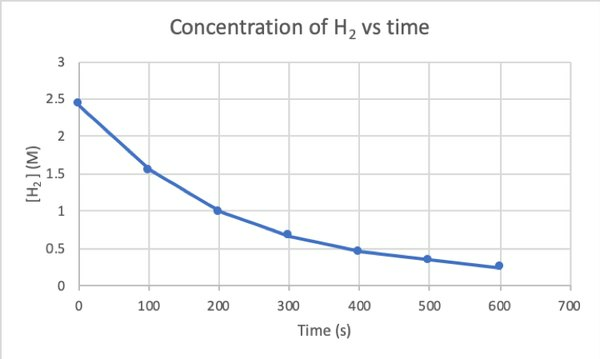
•••Измењено из https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
Тхе просечна брзина реакције је апроксимација брзине реакције у временском интервалу и може се означити са:
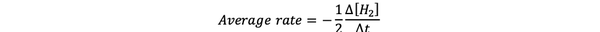
•••Измењено из https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
Тхе тренутна брзина реакције се дефинише као брзина реакције у неком тренутку. То је диференцијална стопа и може се изразити:
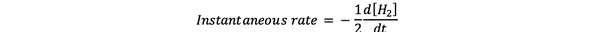
•••Измењено из https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
Где је д [Х.2] / дт је нагиб криве концентрације Х2 наспрам времена у времену т.
Тхе почетна брзина реакције је тренутна брзина на почетку реакције, када је т = 0. У овом случају, јединица за просечну тренутну и почетну брзину реакције је М / с.
Оцените закон
У већини случајева, брзина реакције зависи од концентрације различитих реактаната у тренутку т. На пример, у већој концентрацији свих реактаната, реактанти се чешће сударају и резултирају бржом реакцијом. Однос између брзине реакције ν (т) и концентрација дефинисан је као закон о стопи. А закон брзине за општу хемијску реакцију аА + бБ> цЦ + дД је:
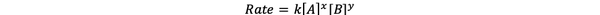
•••Измењено из https://chem.libretexts.org/Bookshelves/Ancillary_Materials/Laboratory_Experiments/Wet_Lab_Experiments/General_Chemistry_Labs/Online_Chemistry_Lab_Manual/Chem_12_Experiments/01%3A_Chemical_Kinetics_-_The_Method_of_Initial_Rates_(Experiment)
Где је к константа брзине, а снага к и и је ред реакције у односу на реактант А и Б. Закон брзине мора се одредити експериментално и не може се извести само из стехиометрије уравнотежене хемијске реакције.
Метод почетних цена
Закон о стопи може одредити метода почетних стопа. У овој методи, експеримент се изводи више пута, мењајући само концентрацију једног реактанта за сваку серију, а остале променљиве одржава константним. Брзина реакције мери се за сваку серију да би се одредио редослед сваког реактанта у закону брзине.
На пример, узмите у обзир следеће почетне податке о брзини реакције:
2 НЕ (г) + 2 Х.2 (г)> Н.2(г) + 2Х2О (г)
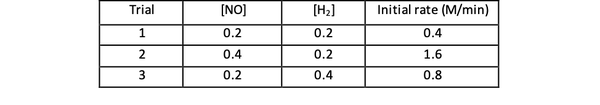
•••Адаптиран од https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
За испитивања 1 и 3 концентрација НО се одржава константном, док концентрација Х2 је удвостручен. Као резултат, почетна брзина реакције се такође удвостручила (замислите као 21), па можете закључити и = 1. За испитивања 1 и 2 концентрација НО се удвостручује, док се концентрација Х.2 остаје константан. Резултат ове промене је да се почетна стопа учетворостручила (замислите као 22). Стога можете закључити к = 2.
Стога је закон о стопи за ову реакцију:
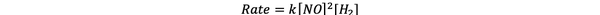
•••Адаптиран од https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
И реакција је првог реда у Х2 и друга наруџба у НО.
