Kemijska formula je poenostavljen, standardni zapis za razlago kemijske reakcije, ki se uporablja v poskusih. Morda so videti zapletene, toda ko se naučite, kako jih prebrati, postanejo dokaj samoumevne.
Kemijsko reakcijo, ki jo poskušate razbiti, poglejte kot enačbo. Poiščite ključne besede, zlasti kemijske sestavine. Na primer, metan (CH4) sežge, kar vedno pomeni, da se dela v kisiku (O2). Tako dobimo hlape ogljikovega dioksida (CO2) in vode (H2O). Upoštevajte lokacijo besede "Pridelki", saj je to pomembno.
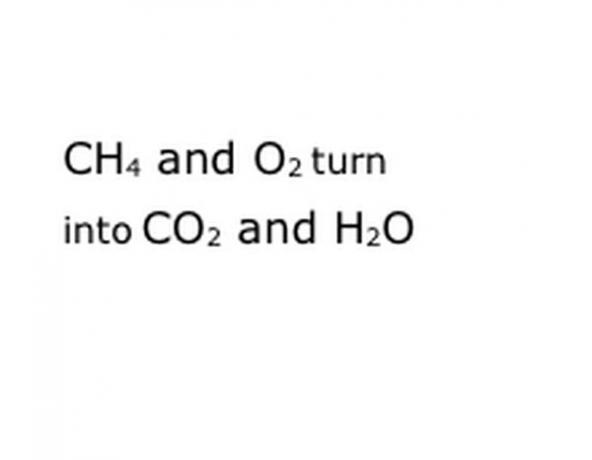
Kemijske sestavine reakcije zapišite v standardni obliki zapisa. V našem primeru bodo to CH4, O2, CO2 in H2O. V kemiji "donos" pomeni, da se tisto, kar je prej, spremeni v tisto, kar pride pozneje, zato bodite prepričani, da je "donos" približno na sredini. Ta stavek bo predstavljal dejansko kemično reakcijo, v tem primeru gorenje. Torej vse, kar boste zažgali, mora biti pred tem, vse, kar bo dala reakcija, pa mora biti po njem.
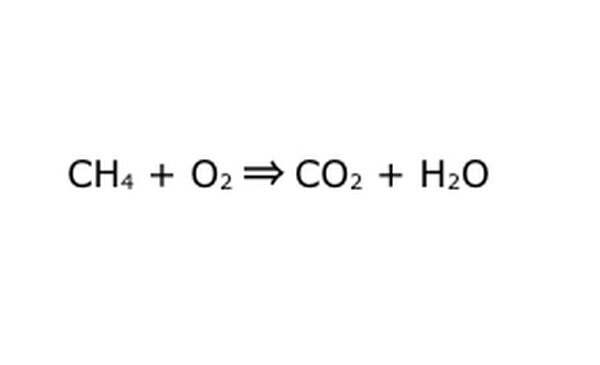
Napiši enačbo kot matematični postopek. "Donos" ali "spremeni v" zamenjajte s puščico, med kemičnimi komponentami pa narišite znake plus. Za poenostavitev si omislite vsako kemično komponento kot posamezno molekulo. Mogoče bo pomagalo molekule potegniti na kos odpadnega papirja. Prepričajte se, da so predstavljene vse molekule, ki vstopajo. Če v končnem izdelku kaj manjka, lahko to dodate tako, da je smiselno - preverite karkoli glede tega, kar veste o kovalentni vezavi. Ker se večina poskusov izvaja v običajni atmosferi, lahko po potrebi dodate O2 v reakcije gorenja. Če je enačba reverzibilna, mora imeti dvojno puščico, ki to predstavlja.
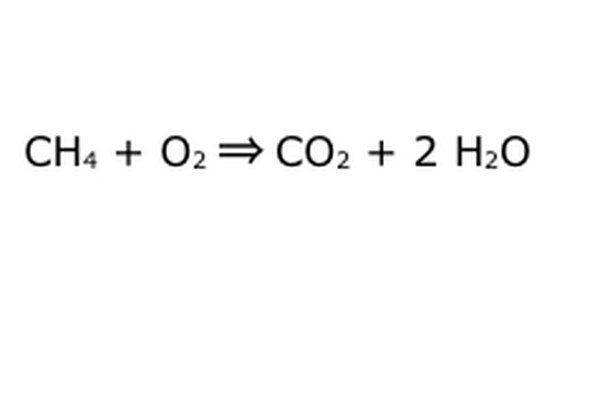
Uravnajte svojo enačbo. Tu nastopi Zakon o ohranjanju: pomislite na puščico, našo reakcijo, kot na stroj, v katerega ste odvrgli vse komponente na levi. Naprava ne bo naredila ali dodala ničesar, česar niste vložili, zato bo izpljunil samo enako količino stvari, kot ste jih dali. V tem natančnem trenutku imamo dve odvečni molekuli vodika, ki plavata naokoli, ker vstavite "4". Edino, kamor lahko gre v tem stroju, je eden izmed izdelkov, zato bo moral v molekule vode. Napiši "2" pred H2O in označi, da boš za vsak vloženi CH4 dobil dva H2O nazaj.

Upoštevajte, da je z našo enačbo še vedno majhen problem: premalo kisika vstopa. Prihajajo štirje atomi kisika, vstopajo pa le dva, zato je vse skupaj še vedno neuravnoteženo. Pred O2 napišite "2", ki pomeni, da morate vnesti dva O2, da boste lahko dovolj iz reakcije.
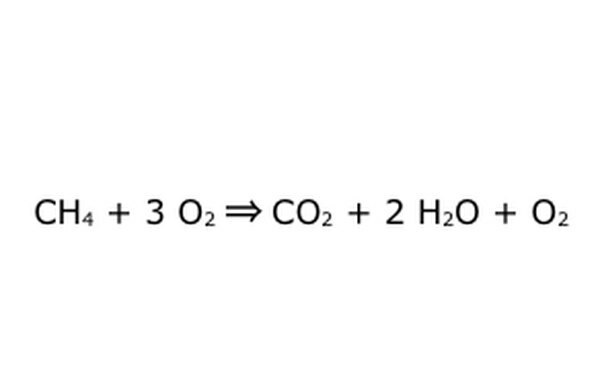
Upoštevajte, da je tak postopek mogoče izvesti "s presežkom kisika." To pomeni, da enačba vnese več kisika, kot je potrebno, in dobi več nazaj. Na primer, upoštevajte, da vstopa dodaten O2, zato pride ven dodaten. Prepričajte se le, da se ves čas upošteva zakon o ohranjanju. Karkoli vstopi, mora priti ven.
Nasveti
Na splošno se kemikalije v teh vrstah enačb merijo v molih. Mol je enota, ki predstavlja 6,0221415 10 ^ (23) molekul. Ker je to številka veliko prevelika, da bi jo lahko razumeli, je pri uravnoteženju lažje razmišljati z eno molekulo. Zavedajte se tega ob začetku.
