Carbonul este un element nemetalic cu un simbol chimic al lui C. Este al patrulea element din abundență din univers și al 15-lea cel mai abundent element din scoarța Pământului. Este, de asemenea, al doilea cel mai abundent element la om după oxigen. Machiajul său chimic duce la câteva proprietăți unice ale carbonului.
Carbonul aparține grupului 14 din tabelul periodic. Numărul său atomic este 6 și are o greutate atomică de 12.011. Stările de oxidare ale carbonului pot varia de la -4 la +4, unde +4 există în compuși precum metan și disulfură de carbon și +2 pentru monoxidul de carbon.
Proprietățile fizice ale diferitelor alotrope de carbon le fac utile în baterii, electronice și nanomateriale. Carbonul este, de asemenea, „regele elementelor”, formându-se aproape 10 milioane de compuși până în prezent, inclusiv compuși organici, anorganici și organometalici.
Izotopii de carbon sunt folosiți pe scară largă pentru datarea radiocarbonată (carbon-14), structura moleculară și cercetarea medicală (carbon-13). În plus, fibrele de carbon prezintă proprietăți mecanice excelente și sunt populare în industria aerospațială și civilă.
Alotropii de carbon
Carbonul are diferite forme alotrope, cu configurații moleculare și structuri atomice diverse. Proprietățile fizice ale carbonului variază foarte mult cu fiecare alotrop. Unele dintre cele mai cunoscute alotropi de carbon includ grafit, diamant și fulereni.
Grafitul este unul dintre cele mai moi materiale cunoscute și este utilizat în creioane și ca lubrifiant solid. Este, de asemenea, un bun conductor de electricitate, făcându-l util în baterii și panouri solare.
Grafenul este pur și simplu un strat atomic de grafit dispus într-o rețea de tip fagure. Într-un strat de grafen, fiecare atom de carbon este legat covalent de alți trei atomi, lăsând cel de-al patrulea electron liber să migreze în plan, de unde și conductivitatea sa electrică.
Dimpotrivă, diamantul este cea mai dură substanță naturală și este una dintre proprietățile unice ale carbonului. Are aproape de două ori densitatea grafitului și fiecare atom de carbon este legat tetraedric de alți patru fără electroni care curg liber. Astfel, diamantul este un conductor slab al electricității. Diamantul are, de asemenea, un aspect clar, spre deosebire de grafit, care este opac.
Oamenii de știință au sintetizat, de asemenea, alte alotropi de carbon, cum ar fi fulerenele, nanofumurile de carbon și altele. Au proprietăți speciale și constituie o zonă înfloritoare de cercetare în nanomateriale. Fullerenele sunt un grup de molecule de carbon goale într-o cușcă închisă (buckyball) sau în cilindru (nanotuburi de carbon).
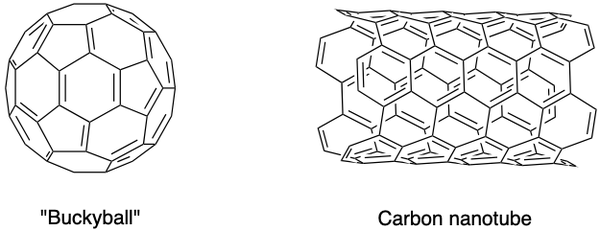
•••Creat folosind ChemDraw
C60 buckyball a fost descoperit de Sir Harold Kroto, Richard Smalley și Robert Curl Jr., folosind un laser pentru vaporizarea tijelor de grafit într-o atmosferă de heliu. Atomii de carbon sunt uniți între ei prin legături simple și duble pentru a forma 12 fețe pentagonale și 20 de fețe hexagonale în formă de minge de fotbal. Eforturile lor de pionierat le-au adus Premiul Nobel în 1996.
Nanotuburile de carbon, care sunt versiuni alungite ale buckyballs, au fost identificate de Iijima Sumio. Sunt conductori excelenți ai căldurii și electricității și sunt utili pentru electronică.
Nanotuburile de carbon demonstrează, de asemenea, o rezistență la tracțiune impresionantă și au aplicații interesante în materiale structurale și medicină. Cu toate acestea, sinteza controlată a acestor nanomateriale a reprezentat o mare provocare pentru oamenii de știință.
Reactivitatea chimică a carbonului
Carbonul constituie baza vieții pe Pământ, milioane de compuși care conțin carbon reprezintă 18% din toate ființele vii. Poate forma legături stabile și covalente cu alți atomi și poate apărea ca lanțuri lungi sau inele de legături puternice interconectate carbon-carbon. Acestea contribuie la diversitatea și complexitatea compușilor de carbon existenți pe Pământ.
Aceste compuși de carbon includ molecule organice precum proteine, carbohidrați și ADN care se găsesc în celulele organismelor vii, precum și compuși anorganici, cum ar fi oxizii de carbon. Studiul moleculelor organice constituie un domeniu specializat numit chimie organică. Carbonul poate forma, de asemenea, legături covalente cu metalul ca compuși organometalici. Porfirina de fier, care este locul de legare a oxigenului al hemoglobinei, este un astfel de exemplu.
În ciuda abundenței sale în natură, carbonul este relativ nereactiv în condiții normale. La temperatura standard, nu este reactiv față de acizi (acid sulfuric sau acid clorhidric) sau alcali. De asemenea, este stabil la oxidare la această temperatură. Cu toate acestea, la temperaturi mai ridicate, carbonul poate reacționa cu oxigenul pentru a forma oxizi de carbon (CO2 și CO), cu gaz de sulf pentru a forma disulfură de carbon și cu siliciu pentru a forma carburi.
Izotopi de carbon
Există 15 izotopi cunoscuți ai carbonului, dintre care carbon-12 (98,93% din carbonul natural) și carbon-13 (1,07%) sunt cei doi izotopi stabili. Carbon-14 este cel mai longeviv izotop, cu un timp de înjumătățire de 5.730 de ani. Cel mai scurt izotop de carbon este carbon-8 și are un timp de înjumătățire de 1,98739 x 10−21 secunde.
Izotopul carbon-14 este reprezentat de 146C, unde presuperscriptul 14 este masa atomică, iar presubscriptul 6 este numărul atomic. Carbon-14 are o abundență naturală foarte mică (0,0000000001 la sută), dar timpul său de înjumătățire lung îl face util pentru datarea radiometrică.
Carbon-14 se formează atunci când azotul-14 reacționează cu neutronii din radiația cosmică, eliberând un proton în acest proces. Carbonul 14 reacționează apoi cu oxigenul pentru a genera 14CO2, care se distribuie uniform în atmosferă cu 12CO2.
147N + 10n> 146C + 11p
Ciclul carbonului începe atunci când organismele vii convertesc dioxidul de carbon (14CO2 și 12CO2 din atmosferă) în compuși organici prin fotosinteză și o eliberează înapoi în atmosferă prin respirație. În acest echilibru, există un raport fix de 14CO2 și 12CO2 în organisme. Cu toate acestea, atunci când mor, echilibrul se oprește, iar carbonul-14 suferă o descompunere beta până la azotul-14 în conformitate cu timpul său de înjumătățire de 5.730 de ani.
146C> 147N + 0-1e
Măsurarea proporției relative de carbon-14 într-un specimen mort permite astfel calcularea timpului scurs după moartea acestuia. Această metodă de datare cu radiocarbon a fost utilizată pe scară largă pentru datarea fosilelor și a specimenelor arheologice vechi de la 500 la 50.000 de ani.
Carbon-13 este un alt izotop care este utilizat pe scară largă în multe aplicații. De exemplu, este utilizat în rezonanța magnetică nucleară (RMN) pentru determinarea structurilor moleculare ale compușilor organici. De asemenea, este utilizat ca instrument de etichetare în combinație cu un spectrometru de masă pentru cercetarea medicală.
Proprietățile mecanice ale fibrelor de carbon
Carbonul prezintă, de asemenea, proprietăți mecanice utile, altele decât proprietățile sale fizice, chimice și nucleare.
Se poate forma aliaje cu oțel în oțel carbon, din care conținutul de carbon variază de la 0,05 la 2% din greutate. Oțelul cu carbon mediu (0,3-0,6% carbon) are rezistență și ductilitate echilibrate, precum și rezistență excelentă la tracțiune. Printr-un proces de tratare termică, oțelul cu conținut ridicat de carbon (1,25-2% carbon) poate fi călit la o duritate mare și utilizat pentru fabricarea cuțitelor.
Fibrele de carbon, care sunt fibre groase de 5 până la 10 μm, compuse în mare parte din atomi de carbon, au o valoare ridicată rigiditate, rezistență la tracțiune, rezistență chimică, toleranță la temperatură și greutate redusă și termică expansiune. Rezistența la randament a oțelului depinde de calitatea sa, iar oțelul ușor are o rezistență la randament de 247 MPa. Fibrele de carbon au rezistențe la tracțiune cuprinse între 1.600 și 6.370 MPa și, prin urmare, sunt populare în domeniul aerospațial, inginerie civilă și sport.
Când se exercită o solicitare asupra unui material, acesta se deformează elastic la început. În acest stadiu, poate reveni la forma inițială atunci când stresul este eliminat. Redați forța este definit ca solicitarea pe care o poate suporta un material fără deformare permanentă.
Când ajunge la un punct (punctul de randament superior) în care nu mai poate reveni la dimensiunile sale inițiale, suferă o deformare plastică, care este permanentă și ireversibilă. Rezistența la tracțiune este rezistența maximă pe care o poate rezista un material fără a se defecta sau rupe.
