Cinetica este ramura chimiei fizice care studiază viteza reacțiilor chimice. În contrast, termodinamica ne spune ce direcție a reacției este favorizată, fără a dezvălui viteza de reacție a acesteia. Unele reacții pot fi favorizate termodinamic, dar cinetic defavorizate.
De exemplu, în conversia diamantului în grafit, grafitul are o energie liberă mai mică decât diamantul, deci conversia este favorizată termodinamic. Cu toate acestea, există o mare barieră de activare pentru ca diamantul să se rupă și să reformeze toate legăturile cu mai mult configurație stabilă de grafit, astfel această reacție este defavorizată cinetic și nu va avea loc de fapt.
Rata de reacție
viteza de reacție este o măsură a vitezei în care se formează produsele și se consumă reactanții, astfel încât să o puteți determina măsurând schimbarea concentrației de produse sau reactanți, pe o perioadă de timp. Luați în considerare o reacție chimică generală:
aA + bB> cC + dD
Rata de reacție poate fi scrisă ca:
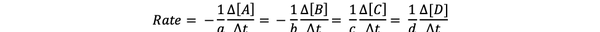
•••Modificat din https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
De exemplu, rata de reacție pentru:
2 NO (g) + 2 H2 (g)> N2(g) + 2 H2O (g)
este dat de
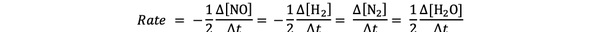
•••Luat din https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
Pentru a determina rata acestei reacții prin experiment, puteți măsura concentrația de H2 în diferite momente ale reacției și trageți-o în funcție de timp după cum urmează:
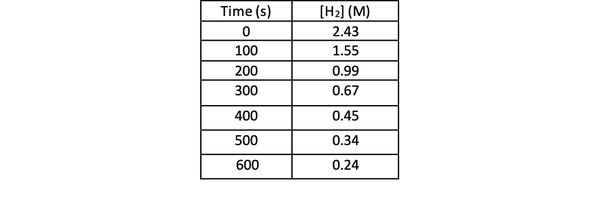
•••Modificat din https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
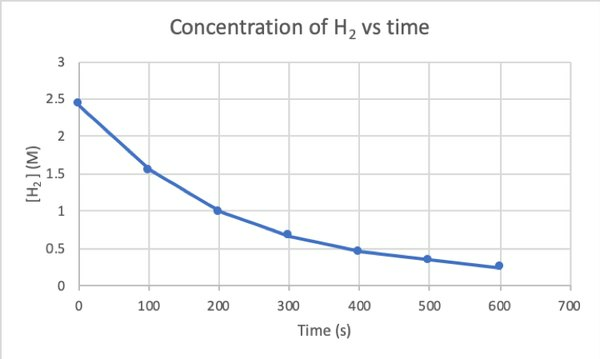
•••Modificat din https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
rata medie de reacție este o aproximare a vitezei de reacție într-un interval de timp și poate fi notată prin:
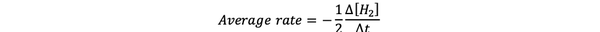
•••Modificat din https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
viteza instantanee de reacție este definit ca viteza de reacție la un moment dat în timp. Este o rată diferențială și poate fi exprimată prin:
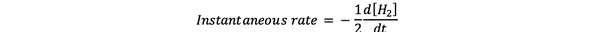
•••Modificat din https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
Unde d [H2] / dt este panta curbei de concentrație a lui H2 versus timp la timp t.
viteza inițială de reacție este rata instantanee la începutul reacției, când t = 0. În acest caz, unitate pentru viteza medie, instantanee și inițiale de reacție este M / s.
Legea tarifelor
În majoritatea cazurilor, viteza de reacție este dependentă de concentrația diferiților reactanți la momentul t. De exemplu, într-o concentrație mai mare a tuturor reactanților, reactanții se ciocnesc mai frecvent și duc la o reacție mai rapidă. Relația dintre viteza de reacție ν (t) și concentrațiile este definită ca legea ratei. Și legea vitezei pentru reacția chimică generală aA + bB> cC + dD este:
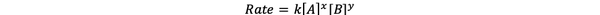
•••Modificat din https://chem.libretexts.org/Bookshelves/Ancillary_Materials/Laboratory_Experiments/Wet_Lab_Experiments/General_Chemistry_Labs/Online_Chemistry_Lab_Manual/Chem_12_Experiments/01%3A_Chemical_Kinetics_-_The_Method_of_Initial_Rates_(Experiment)
Unde k este rata constantă, iar puterea x și y este Ordin a reacției față de reactivul A și B. Legea vitezei trebuie determinată experimental și nu poate fi dedusă doar din stoichiometria unei reacții chimice echilibrate.
Metoda tarifelor inițiale
Legea ratei poate fi determinată de metoda ratelor inițiale. În această metodă, experimentul se efectuează de mai multe ori, schimbând doar concentrația unui reactant pentru fiecare rulare, păstrând în același timp alte variabile constante. Viteza reacției este măsurată pentru fiecare cursă pentru a determina ordinea fiecărui reactant în legea vitezei.
De exemplu, luați în considerare următoarele date privind viteza inițială pentru reacție:
2 NO (g) + 2 H2 (g)> N2(g) + 2 H2O (g)
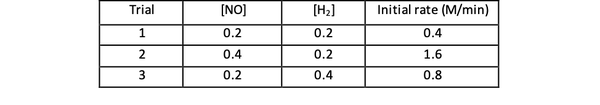
•••Luat din https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
Pentru procesele 1 și 3, concentrația de NO este menținută constantă în timp ce concentrația de H2 este dublat. Ca rezultat, de asemenea, viteza inițială de reacție s-a dublat (gândiți-vă la 21), deci puteți concluziona y = 1. Pentru procesele 1 și 2, concentrația de NO este dublată în timp ce concentrația de H2 ramane constant. Rezultatul acestei modificări este că rata inițială a crescut de patru ori (gândiți-vă la aceasta ca fiind 22). Prin urmare, puteți concluziona x = 2.
Prin urmare, legea vitezei pentru această reacție este:
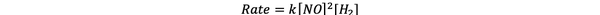
•••Luat din https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
Și reacția este prima comanda în H2 și a doua comanda în NR.
